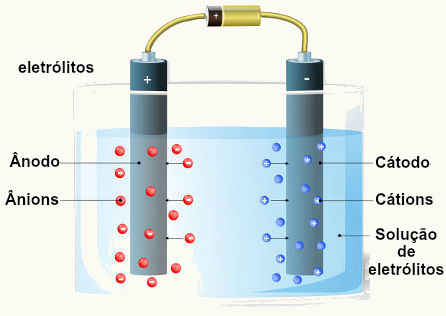
A eletrólise é um processo em que se coloca uma substância no estado líquido ou em solução aquosa que contenha íons em um recipiente chamado de cuba eletrolítica e passa-se uma corrente elétrica pelo líquido por meio de dois eletrodos (polo negativo – cátodo – e polo positivo – ânodo) ligados a um gerador (como uma bateria) externo.
Essa corrente elétrica faz com que ocorram reações de oxirredução no líquido ou solução que formam determinados produtos desejados. Desse modo, a eletrólise pode ser dita como um processo que transforma energia elétrica (que vem do gerador) em energia química (reações químicas).
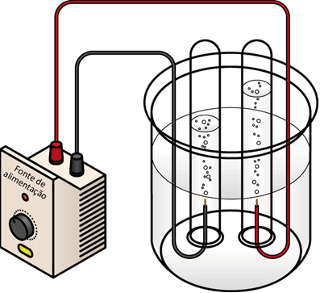
No entanto, em indústrias, a eletrólise não é realizada com uma única cuba eletrolítica como explicado até agora. Na verdade, para que se produza mais e em menor tempo, são realizadas eletrólises em série. A eletrólise em série é feita por conectar os eletrodos de várias cubas eletrolíticas (que em indústrias, na verdade, são tanques) de forma intercalada (o cátodo de uma cuba eletrolítica liga-se ao ânodo da outra cuba eletrolítica e assim sucessivamente). A corrente elétrica é proveniente de um único gerador.

Esquema de eletrólise em série com três cubas interligadas
Mas como resolver exercícios que envolvem eletrólise em série? Como podemos descobrir, por exemplo, a quantidade de massa dos metais que se deposita nos eletrodos de cada cuba? E como saber a quantidade de carga elétrica que foi usada?
Para tal, aplicamos a segunda lei de Faraday, que diz respeito a substâncias diferentes que são submetidas a uma mesma carga elétrica. Visto que são substâncias diferentes, as massas dos metais depositadas em cada cuba também são diferentes, apesar de ser usada a mesma carga elétrica.
A segunda lei de Faraday diz o seguinte:
“Empregando-se a mesma quantidade de carga elétrica (Q), em diversos eletrólitos, a massa da substância eletrolisada, em qualquer dos eletrodos, é diretamente proporcional à massa molar da substância.”
Por exemplo, imagine que, em um dos cátodos, haja a semirreação a seguir que resulta no depósito de prata metálica no eletrodo:
Ag++ 1 e- → Ag
No outro eletrodo de outra cuba eletrolítica, há a seguinte semirreação que resulta no depósito de alumínio metálico no cátodo:
Al3+ + 3 e- → Al
Analisando essas duas semirreações de redução, vemos que as massas desses dois metais são diferentes porque o íon Al3+ é tripositivo, exigindo o triplo de elétrons que o íon Ag+ , que é monopositivo.
Além das cargas dos íons, a massa molar da prata é igual a 108 g/mol e a do alumínio é 27 g/mol, o que mostra que esse é outro fator que também interfere na quantidade de massa desses metais que é depositada em cada cátodo.
Veja um exemplo de questão que envolve uma eletrólise com a aplicação dos conceitos estudados até agora:
Exemplo:
Uma cuba eletrolítica com eletrodos de cobre que contém uma solução aquosa de Cu(NO3)2 é ligada em série com outras duas cubas eletrolíticas. A segunda cuba é provida de eletrodos de prata e contém solução aquosa de AgNO3, enquanto a terceira cuba possui eletrodos de alumínio e solução aquosa de ZnCl2. Esse conjunto de cubas em série é ligado a uma fonte durante certo intervalo de tempo. Nesse intervalo de tempo, um dos eletrodos de cobre teve um incremento de massa de 0,64 g. O incremento de massa nos cátodos das outras duas células foi de quanto?
(Massas molares: Cu = 64 g/mol; Ag = 108 g/mol; Zn = 65,4 g/mol)
Resolução:
Visto que sabemos a massa de cobre depositada no eletrodo da primeira cuba, podemos descobrir a quantidade de carga elétrica (Q) que foi aplicada e usá-la para determinar as massas dos outros metais que se depositaram.
Primeiro escrevemos a equação da semirreação catódica:
Cu2+ + 2e- → Cu(s)
↓ ↓
2 mol e- 1 mol
Pela primeira lei de Faraday, 1 mol corresponde à carga de 1 F (faraday), que é exatamente igual a 96 500 C. No caso do cobre, são necessários 2 mol de elétrons para reduzir o Cu2+ e produzir 1 mol de Cu(s). A carga elétrica, nesse caso, seria de Q = 2 . 96 500 C = 193 000 C.
Essa carga produz 1 mol de Cu, o que equivale à massa de 64 g. Mas o enunciado disse que nessa eletrólise foi produzido 0,64 g de cobre. Então, fazemos uma regra de três simples para descobrir a carga elétrica que foi usada nessa eletrólise em série:
193 000 C –------ 64 g de Cu
Q ---------- 0,64 g de Cu
Q = 0,64 . 193 000
64
Q = 1930 C
Essa é a carga elétrica usada nas três cubas eletrolíticas. Com esse valor, podemos descobrir agora o que o exercício pediu, a massa dos outros metais que se depositou nos eletrodos das cubas 2 e 3:
* Cuba 2:
Ag++ 1 e- → Ag
↓ ↓
1 mol de e- 1 mol
↓ ↓
96500 C ------ 108 g de Ag (essa é a massa molar da prata)
1930 C ------ m
m = 108 . 1930
96 500
m = 2,16 g de Ag
* Cuba 3:
Zn2++ 2 e- → Zn
↓ ↓
2 mol de e- 1 mol
↓ ↓
2. 96500 C ------ 65,4 g de Zn (essa é a massa molar do zinco)
1930 C ------ m
m = 65,4 . 1930
193 000
m = 0,654 g de Zn
Veja que, ao realizar as regras de três acima para descobrir a quantidade de massa de cada metal obtida, a massa molar (M) do metal aparece no numerador multiplicada pela carga elétrica (Q). Já no denominador estão as cargas dos respectivos íons (q) multiplicadas pela constante de Faraday (1 F = 96 500 C).
Assim, temos a seguinte fórmula:
m = M . Q
q . 96 500
Podemos resolver esse tipo de exercício aplicando diretamente essa fórmula. Veja também que ela corresponde exatamente ao que é dito pela segunda lei de Faraday.