A velocidade das reações químicas é estudada pela Cinética Química. Esse estudo é importante porque precisamos conhecer os fatores que influenciam a taxa de desenvolvimento de uma reação para conseguir acelerar algumas reações químicas que são muito lentas ou retardar algumas que são muito rápidas ou indesejáveis.
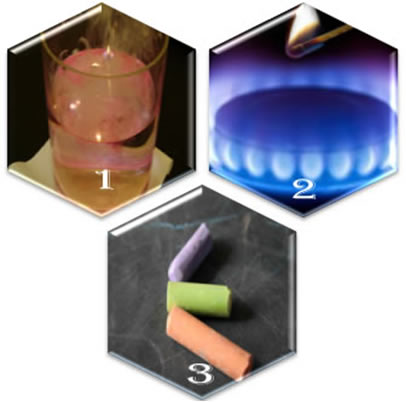
Um dos principais fatores que influenciam a velocidade das reações é a concentração dos reagentes. Se colocarmos o zinco mergulhado em duas soluções de ácido sulfúrico, sendo uma mais diluída (com mais água) e outra mais concentrada, por exemplo, veremos que o recipiente que contém o zinco na solução mais concentrada de ácido sulfúrico formará uma efervescência bem nítida, conforme a imagem no início deste artigo mostra.
Por outro lado, não ocorre praticamente nenhuma alteração no recipiente que contém o zinco mergulhado em uma solução bem diluída de ácido sulfúrico.
Por que isso ocorre? Bem, a reação entre o zinco e o ácido sulfúrico pode ser vista a seguir:
Zn + H2SO4 → ZnSO4 + H2
Observe que há a formação do gás hidrogênio. As bolhas formadas são desse gás e indicam não só a ocorrência da reação, mas também que a reação se torna bem mais rápida quando se usa uma concentração maior de ácido sulfúrico.
Outro exemplo é quando temos uma reação de combustão ao ar livre e outra ocorrendo dentro de um recipiente fechado com gás oxigênio puro. A chama torna-se bem mais intensa quando a queima ocorre dentro do recipiente com oxigênio puro, ou seja, onde o combustível reage com 100% de moléculas de oxigênio. Já a combustão ao ar livre contém apenas 20% de moléculas do gás oxigênio, pois o ar é constituído de cerca de 79% de moléculas de gás nitrogênio e 1% de outros gases.
Esses dois exemplos mostram o efeito da concentração na velocidade das reações, que é o seguinte:
“Quanto maior a concentração dos reagentes, maior será a velocidade de uma reação.”
Isso é explicado quando analisamos a teoria das colisões, que diz que, para que a reação química ocorra, as partículas (moléculas, átomos, íons etc.) dos reagentes devem colidir entre si. Mas essa colisão deve ser efetiva, ou seja, deve ser feita em uma orientação adequada e com energia suficiente.
Assim, quando aumentamos a concentração de um ou mais reagentes, a quantidade de partículas deles aumenta no meio. Consequentemente, ocorrem mais colisões entre as partículas, e a probabilidade de ocorrerem colisões efetivas (que resultem na reação) torna-se maior, o que ocasiona um aumento da velocidade da reação.
De forma resumida, temos:

Relação entre concentração e velocidade das reações
Videoaula relacionada: