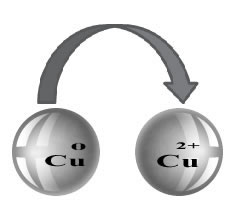
O Número de Oxidação (Nox) ajuda-nos a identificar como os elétrons estão distribuídos em uma reação de oxidorredução, ou seja, em uma reação em que há transferência de elétrons de uma espécie química para outra.
*Composto iônico → O Número de Oxidação (Nox) corresponde à quantidade de elétrons que foram perdidos ou ganhados por meio das ligações feitas.
*Composto Molecular → O Número de Oxidação (Nox) refere-se à quantidade de elétrons que o elemento ganharia ou perderia se a ligação fosse rompida.
Como o Número de Oxidação varia de um elemento para o outro e também esse próprio elemento pode ter seu Nox mudado, dependendo do composto que ele está formando e da ligação que ele está fazendo; serão determinadas a seguir algumas regras que ajudam na determinação do Número de Oxidação (Nox).
a) Sempre que a substância for simples, o seu Nox é igual a zero. Exemplos de substâncias simples: O2, H2, O3, P4, S8, etc.
b) No caso de íons monoatômicos (compostos de um único átomo), o seu Nox será igual à sua carga. Exemplos:
K+→Nox = +1
F-→Nox = -1
Ba2+→Nox = +2
c) O Nox do hidrogênio costuma ser +1 e do oxigênio -2.
d) Alguns elementos e famílias de elementos apresentam Nox fixo:

e) Halogênios (elementos da família 17 ou VII A) em compostos binários (formados por dois elementos) apresentam Nox -1. Exemplos:
HCl, MnBr2, CF4, entre outros.
f) A soma dos números de oxidação de todos os elementos do composto tem que dar zero. Tomemos como exemplo o H3PO4, onde já sabemos que o Nox do H é +1 e do O é -2; multiplicando esses valores pelos seus respectivos índices e considerando a somatória dos Nox igual a zero, iremos determinar o Nox do P, que chamaremos de x:

Assim, o Nox de P neste composto é igual a +5.
g) Se o composto for um íon, a soma dos números de oxidação de todos os elementos do composto tem que dar igual à sua carga.
No exemplo abaixo seguiremos o mesmo padrão dado no item anterior, com apenas uma diferença: neste caso a somatória dos Nox será igual à carga do íon composto:

Portanto, o Nox de Cr neste íon composto acima é igual a +6.
Aproveite para conferir nossas videoaulas sobre o assunto: