No ano de 1888, o químico francês Henri Louis Le Chatelier formulou o princípio que explicava o deslocamento de um equilíbrio químico quando um determinado processo químico era submetido a algum tipo de perturbação
Um equilíbrio químico existe quando a velocidade em que os reagentes tornam-se produtos é a mesma em que os produtos tornam-se reagentes. Em seus estudos, Le Chatelier observou que apenas as variáveis pressão, concentração e temperatura eram capazes de deslocar um equilíbrio.
Segundo seus estudos, um equilíbrio químico era deslocado quando um dos três fatores citados eram alterados. Quando isso acontece, o processo químico sempre busca uma nova forma de voltar à situação de equilíbrio. Baseado nisso, ele propôs o denominado princípio de Le Chatelier:
''Quando um sistema em equilíbrio for perturbado, este será deslocado no sentido da reação (direta ou inversa) que tende a anular a pertubação e favorecer o estabelecimento de um novo equilíbrio.”
Agora vamos entender melhor como ocorre o deslocamento de um equilíbrio químico em cada uma das formas de perturbação estudadas por Le Chatelier:
→ Influência da concentração no deslocamento de um equilíbrio químico
A concentração, quando modificada em um equilíbrio químico, sempre está relacionada com a quantidade em mol de um determinado participante do processo. Como envolve quantidade, podemos, então:
a) Aumentar a quantidade de um participante (substância)
Sempre que a quantidade de uma das substâncias presentes no equilíbrio for aumentada, o equilíbrio será deslocado no sentido que consuma esse participante.
b) Diminuir a quantidade de um participante
Sempre que a quantidade de uma das substâncias presentes no equilíbrio for diminuída, o equilíbrio será deslocado no sentido que forme (reponha) esse participante.
Por exemplo, dado o equilíbrio:
![]()
Equação de decomposição da amônia
-
Aumentar a concentração de NH3
Quando a concentração do NH3 for aumentada, o equilíbrio será deslocado no sentido de consumir o participante que foi aumentado. Assim, nesse caso, o equilíbrio será deslocado para a direita.
-
Aumentar a concentração do H2
Quando a concentração do H2 for aumentada, o equilíbrio será deslocado no sentido de consumir o participante que foi aumentado. Assim, nesse caso, o equilíbrio será deslocado para a esquerda.
-
Diminuir a concentração do N2
Quando a concentração do N2 for diminuída, o equilíbrio será deslocado no sentido de repor o participante que foi reduzido. Assim, nesse caso, o equilíbrio será deslocado para direita.
→ Influência da temperatura no deslocamento de um equilíbrio químico
A capacidade da modificação da temperatura de promover o deslocamento de um equilíbrio químico é facilmente percebida quando conhecemos a variação da entalpia (ΔH) da reação. O conhecimento do ΔH indica a natureza das reações direta e inversa de um processo químico.
a) Quando o ΔH é positivo (maior que 0)
A reação direta é endotérmica e a reação inversa é exotérmica:
![]()
b) Quando o ΔH é negativo (menor que 0)
A reação direta é exotérmica e a reação inversa é endotérmica:
![]()
Por exemplo, dado o equilíbrio:

Equação de decomposição da amônia com variação de entalpia
Como o ΔH é positivo, a reação direta é endotérmica e a reação inversa é exotérmica. Com isso, podemos avaliar o efeito da modificação da temperatura nesse equilíbrio químico:
-
Aumento da temperatura
De acordo com o princípio de Le Chatelier, um equilíbrio químico perturbado sempre trabalha no sentido de reduzir a pertubação e voltar à situação de equilíbrio. Quando a temperatura é aumentada, o equilíbrio tende a se deslocar para o sentido endotérmico e vice-versa.
Dessa forma, se a temperatura for aumentada na reação de decomposição da amônia, o equilíbrio será deslocado no sentido endotérmico, que, no caso, é à direita.
-
Diminuição da temperatura
Se a temperatura for diminuída na reação de decomposição da amônia, o equilíbrio será deslocado no sentido exotérmico, isto é, à esquerda.
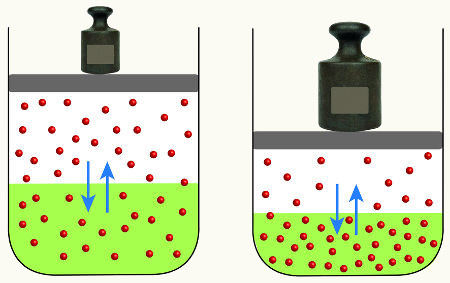
→ Influência da pressão no deslocamento de um equilíbrio químico
A modificação da pressão pode deslocar um equilíbrio químico apenas se ele apresentar um ou mais participantes gasosos. Além disso, não podemos esquecer que pressão (força exercida sobre uma área) e volume (espaço) estão sempre relacionados da seguinte forma:
a) Maior volume = Menor pressão
Quanto maior o espaço (área), menor será o número de vezes em que as moléculas de um gás terão a oportunidade de chocar-se entre si e com as paredes do recipiente.
b) Menor volume = Maior pressão
Quanto menor o espaço (área), maior será o número de vezes em que as moléculas de um gás terão a oportunidade de chocar-se entre si e com as paredes do recipiente.
No caso de um equilíbrio químico, avaliamos a influência da mudança da pressão utilizando os coeficiente estequiométricos como unidades de volume. Por exemplo, dado o equilíbrio:
![]()
Equação de decomposição da amônia
No reagente da equação, temos o coeficiente 2 para o NH3; nos produtos, temos os coeficientes 1 para o N2 e o 3 para o H2. Assim, consideramos que o volume do reagente é 2V e o volume dos produtos é 4V. Com isso, podemos avaliar o efeito da pressão sobre esse equilíbrio:
-
Aumento da pressão
De acordo com o princípio de Le Chatelier, um equilíbrio químico perturbado sempre trabalha no sentido de reduzir a pertubação e voltar à situação de equilíbrio. Como pressão e volume são inversamente proporcionais, aumentando um, o equilíbrio sempre será deslocado para o lado do menor e vice-versa.
Dessa forma, se a pressão for aumentada na reação de decomposição da amônia, por exemplo, o equilíbrio será deslocado no sentido de menor volume, isto é, à esquerda.
-
Diminuição da pressão
Se a pressão for diminuída na reação de decomposição da amônia, por exemplo, o equilíbrio será deslocado no sentido de maior volume, isto é, à direita.
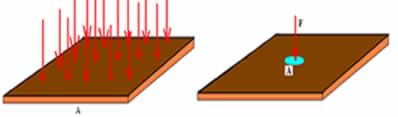
→ Influência de um catalisador no deslocamento de um equilíbrio químico
Uma situação de equilíbrio químico é aquela em que a velocidade da reação direta (Vd) é igual à velocidade da reação inversa (Vi). O catalisador é uma substância que aumenta a velocidade por meio da diminuição da energia de ativação de uma reação química. Por exemplo:
![]()
Equação química com presença do catalisador prata metálica
A prata (Ag) é o catalizador da reação acima. Ela realiza a diminuição da energia de ativação tanto da reação direta quanto da reação inversa; logo, teremos o aumento da velocidade das reações direta e inversa ao mesmo tempo. Por isso, um catalisador não é capaz de promover o deslocamento de um equilíbrio químico.
Aproveite para conferir nossa videoaula sobre o assunto: