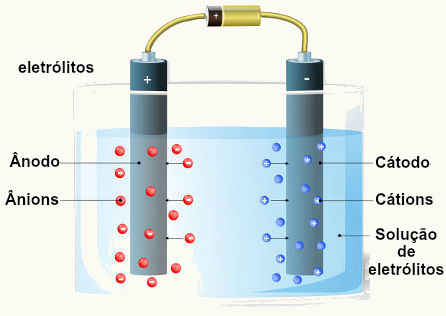
Descarga seletiva de íons (cátions e ânions) é uma regra utilizada por físicos, químicos e cientistas para determinar quais desses íons sofrem os fenômenos da descarga durante o evento da eletrólise.
Quando uma solução aquosa com um sal é preparada para passar pelo procedimento de eletrólise, imediatamente o meio aquoso passa a ter a presença de quatro íons diferentes, sendo dois cátions (o hidrônio-H+, proveniente da água, e um cátion Y+, proveniente do sal) e dois ânions (o hidróxido-OH-, proveniente da água, e um ânion X-, proveniente do sal).
Na eletrólise, assim como nas pilhas, apenas um grupo oxida e outro reduz. Disso provém o termo descarga seletiva de cátions e ânions, pois, quando a corrente elétrica externa chega à solução salina, somente um dos ânions oxida, assim como apenas um dos cátions reduz.
Para determinar qual íon deve oxidar ou reduzir em uma eletrólise realizada em meio aquoso, listamos alguns critérios utilizados pela descarga seletiva de cátions e ânions:
Descarga seletiva de cátions
A ordem de descarga para os cátions segue o padrão da eletropositividade na tabela periódica. Dessa forma, quanto mais eletropositivo for o elemento, menor será sua capacidade de descarga, ou seja, de receber elétrons, quando comparado com o cátion hidrônio proveniente da ionização da água.
Observe a ordem decrescente de eletropositividade para os cátions:
Famílias IA, IIA e IIIA ? H+ ? outros cátions de quaisquer metais
Consequentemente, a ordem decrescente da descarga seletiva para os cátions será:
Outros cátions de quaisquer metais ? H+ ? famílias IA, IIA e IIIA
1º Exemplo: eletrólise aquosa do NaCl
Nessa eletrólise, há a presença dos cátions sódio Na+ (proveniente do sal) e hidrônio H+ (proveniente da água). Como o sódio é da família IA, quando a solução sofre a descarga elétrica, os cátions hidrônio recebem elétrons, ou seja, sofrem redução.
Quando o cátion hidrônio sofre redução, ele sempre recebe dois elétrons e forma a substância simples gás hidrogênio (H2), conforme a equação catódica abaixo:
2 H+ + 2e → H2(g)
2º Exemplo: Eletrólise aquosa do CrSO4
Nessa eletrólise, temos os cátions cromo Cr+2 (proveniente do sal) e hidrônio (H+, proveniente da água). Como o cromo não pertence à família IA, IIA e IIIA, quando a solução sofre a descarga elétrica, são eles que sofrem redução.
Quando o cátion cromo II sofre redução, ele deve receber dois elétrons, formando a substância simples metálica cromo (Cr), como na equação catódica abaixo:
Cr+2 + 2e → Cr(s)
Descarga seletiva de ânions
A ordem de descarga para ânions segue o padrão da eletronegatividade na tabela periódica. Assim, quanto mais eletronegativo for o elemento, menor será sua capacidade de descarga, ou seja, de perder elétrons, quando comparado com o ânion hidróxido (OH-) proveniente da ionização da água.
A seguir, confira a ordem decrescente de eletronegatividade para os ânions:
Ânions oxigenados e fluoreto (F-) ? OH- ? outros ânions de quaisquer ametais
Consequentemente, a ordem decrescente da descarga seletiva para os ânions será:
Outros ânions de quaisquer ametais ? OH- ? ânions oxigenados e fluoreto (F-)
1º Exemplo: eletrólise aquosa do NaCl
Nessa eletrólise, temos os ânions Cl- (proveniente do sal) e hidróxido OH-(proveniente da água). Como o ânion do sal não é oxigenado, quando a solução sofre a descarga elétrica, os ânions cloreto (Cl-) perdem elétrons, ou seja, sofrem oxidação.
Quando o ânion cloreto sofre oxidação, ele perde dois elétrons, formando a substância simples gás cloro (Cl2), como na equação anódica abaixo:
2Cl- → Cl2(g) + 2 e
2º Exemplo: Eletrólise aquosa do CrSO4
Nessa eletrólise, há os ânions SO4-2 (proveniente do sal) e hidróxido OH (proveniente da água). Como o ânion do sal é oxigenado, quando a solução sofre a descarga elétrica, os ânions hidróxido perdem elétrons, ou seja, sofrem oxidação.
Quando o ânion hidróxido sofre oxidação, ele perde dois elétrons, formando a substância simples gás oxigênio (O2) e a substância composta água (H2O), como na equação anódica abaixo:
2 OH- → ½ O2(g) + H2O(l) + 2 e
Aproveite para conferir a nossa videoaula relacionada ao assunto: