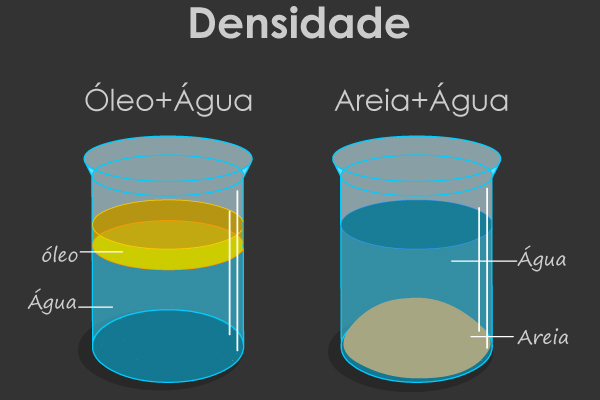
Em muitos parques, shoppings, restaurantes e em outros lugares de passeio e lazer, são vendidas aquelas bexigas (balões de gás) que ficam suspensas no ar. Já as bexigas normais que nós mesmos enchemos com o ar de nossos pulmões tendem a ir para o chão. Qual é a diferença?
A resposta está na densidade dos gases que preenchem ambas as bexigas em relação à densidade do ar.
As bexigas que compramos estão preenchidas com o gás hélio (He), que possui densidade menor que a densidade do ar, por isso sua tendência é subir. Já o gás que sai dos nossos pulmões é o CO2, que possui densidade maior que a densidade do ar, portanto, tende a descer.
Isso que acabamos de fazer, isto é, relacionar as densidades entre dois gases (o gás na bexiga e o ar), é a relação demonstrada pela densidade relativa.

Matematicamente, a densidade relativa entre um gás A e um gás B pode ser expressa da seguinte forma:

Observe que essa grandeza não possui unidade; ela nos mostra a relação entre as densidades de dois gases, isto é, quantas vezes um é mais denso que o outro.
A partir das equações das densidades absolutas dos gases chegamos a uma fórmula mais particularizada da sua densidade relativa:

O mesmo pode ser feito em relação à equação de estado dos gases, tendo em vista que a pressão e a temperatura de ambos os gases não mudam:

Observe que a densidade relativa dos gases é diretamente proporcional às suas massas molares. Desse modo, se a massa molar de determinado gás for menor que a do ar, a sua densidade também será e por isso ele terá a tendência de subir.
Mas qual é a massa molar do ar?
Isso é conseguido por meio da média ponderada da massa molar aparente, ou seja, multiplica-se a massa molar de cada gás componente do ar pelas respectivas frações molares e, posteriormente, faz-se a soma. Os principais gases constituintes do ar são o gás nitrogênio (N2), o gás oxigênio (O2) e o argônio (Ar), cujas porcentagens no ar são, respectivamente, 78%, 21% e 1%.
Assim, as frações molares para cada um desses gases é de: XN2= 0,78, XO2= 0,21e XAr = 0,01. Jogando na fórmula da massa molar aparente para o ar, temos:
Maparente = (XN2 . MN2) + (XO2 . MO2) + (XAr . MAr)
Maparente = (0,78 . 28) + (0,21 . 32) + (0,01 . 40)
Maparente =28,96 g/mol
Portanto, se determinado gás tiver a massa molar menor que 28,96 g/mol, ele irá subir; e se for maior ele irá descer. A massa molar do gás hélio é igual a 4 g/mol, por isso ele sobe. Já a do gás carbônico é de 44 g/mol, consequentemente, ele desce.
O gás cloro (Cl2) possui massa molar de 71 g/mol, bem maior que a massa molar do ar; portanto, ele é mais denso que o ar e tende a ocupar o fundo do recipiente, como mostrado na figura abaixo.

O gás de menor densidade conhecida é o gás hidrogênio (H2), que possui massa molar de apenas 2 g/mol aproximadamente. Antigamente, quando não se conhecia o gás hélio, usava-se o hidrogênio nos chamados Zeppelins, que eram enormes balões “dirigíveis” a gás. No entanto, por ser muito inflamável e perigoso, esse meio de transporte findou-se.

Em 1937 o zeppeling Hindemburg explodiu porque suas câmaras de gás continham gás hidrogênio