O cálculo do número de mol (n) pode ser feito por meio da fórmula:
n = m
M
Onde: m = massa;
M = massa molar.
Se substituirmos a quantidade de matéria ou o número de mol (n) na equação de estado dos gases, também conhecida como equação de Clapeyron (PV = nRT), teremos:
PV = nRT
PV = mRT
M
PV= m
RT M
PM= m
RT V
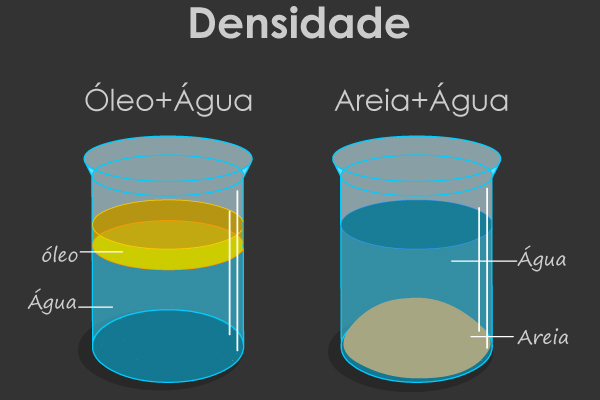
Observe que m/V é exatamente a fórmula química da densidade, portanto, podemos deduzir o seguinte:
d = m
V
PM= m
RT V

Observe como essa equação está correta por meio das unidades, pois sabemos que a unidade de densidade é g/L:

Nas Condições Normais de Temperatura e Pressão (CNTP), em que a pressão é igual a 1 atm e a temperatura é a temperatura absoluta, igual a 273 K, podemos calcular a densidade absoluta:
d = PM
RT
d = ___1 . M___
0,082 . 273

Essa fórmula demonstra a densidade absoluta dos gases e pode nos explicar o princípio de funcionamento dos balões usados como meios de transporte e dos balões de festas juninas que são muito perigosos. O ar contido nesses balões é aquecido e, como a fórmula da densidade absoluta dos gases mostra, sob pressão constante, a densidade do gás é inversamente proporcional à temperatura, por isso, quando se aumenta a temperatura do ar dentro do balão, a densidade dele diminui e com isso o balão passa a voar. Isso ocorre porque quando a temperatura de um gás ou de uma mistura gasosa, como é o caso do ar, aumenta, suas moléculas se afastam e, portanto, seu volume aumenta.

É por isso que os balões de festas juninas são tão perigosos, pois para aumentar a temperatura do ar e fazer o balão subir, coloca-se fogo nele, que uma hora irá cair, podendo causar incêndios e ferimentos graves.