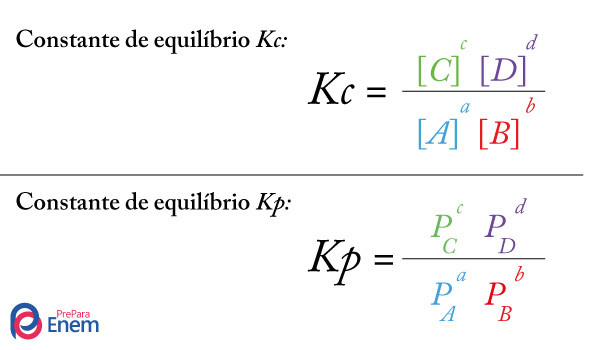Constante de ionização ou constante do equilíbrio de ionização é a relação estabelecida entre as concentrações dos produtos e reagentes participantes de uma ionização (produção de cátions e ânions) ou dissociação (liberação de cátions e ânions).
A forma geral de representar a constante de ionização é por meio da sigla Ki, mas podemos utilizar outras formas a depender do tipo de substância envolvida (se ácido ou base), como:
-
Ka: Constante de ionização do ácido
-
Kb: Constante de ionização da base
-
Kd: Constante de dissociação dos ácidos ou das bases
OBS.: O termo ionização e a sigla Ki podem ser utilizados para qualquer eletrólito (ácidos, bases etc.).
Ionização e dissociação
a) Ionização
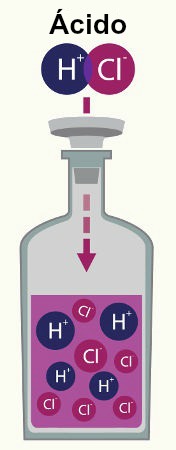
Ionização é o termo utilizado para indicar a produção de um cátion e um ânion a partir de um eletrólito formado por ligações covalentes, como os ácidos quando estão dissolvidos em água.
Quando um ácido é dissolvido em água, ioniza-se e produz o cátion hidrônio (H+ ou H3O+) e um ânion qualquer, como podemos observar na equação geral abaixo:
.jpg)
Equilíbrio de ionização de um ácido qualquer
b) Dissociação:
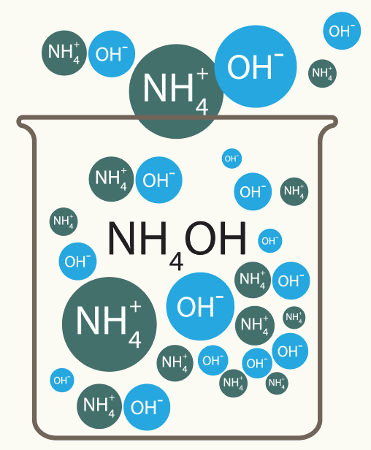
Dissociação é o termo utilizado para indicar a liberação de um cátion e um ânion a partir de um eletrólito formado por ligação iônica, como as bases (YOH) e os sais (YX) quando estão dissolvidos em água.
Quando uma base é dissolvida em água, por exemplo, dissocia-se e libera um cátion diferente do hidrônio e o ânion hidroxila, como podemos observar na equação geral abaixo:
![]()
Equilíbrio de dissociação de uma base qualquer
Expressão da constante de ionização
Assim como em qualquer constante de equilíbrio, a constante de ionização apresenta uma expressão matemática, a qual é montada pela divisão entre a multiplicação das concentrações dos participantes do produto e a multiplicação das concentrações dos participantes do reagente.
OBS.: A água nunca participa de uma expressão da constante de ionização por ser o meio obrigatório para que o fenômeno ocorra.
a) Expressão da constante de ionização para um ácido
Dada a equação de ionização do ácido sulfídrico (H2S):

Equilíbrio de ionização do ácido
A montagem da expressão da constante de ionização do ácido sulfídrico possui as concentrações dos produtos (H+ e S-2) e do reagente (H2S), da seguinte forma:
Ki = [H+]2.[S-2]
[H2S]
OBS.: Como foram produzidos 2 mol de H+, logo, sua concentração deve ser elevada ao quadrado na expressão.
b) Expressão da constante de ionização para uma base
Dada a equação de dissociação do hidróxido de alumínio [Al(OH)3]:

Equilíbrio de dissociação da base
A montagem da expressão da constante de ionização do ácido sulfídrico possui as concentrações dos produtos e do reagente, da seguinte forma:
Ki = [Al+3].[OH-]3
[Al(OH)3]
OBS.: Como foram produzidos 3 mol de OH-, logo, sua concentração deve ser elevada ao cubo na expressão.
Interpretações da constante de ionização
a) Valor alto do Ki
Para afirmar que o resultado do cálculo da constante de ionização é alto, é necessário que tenhamos uma referência. O valor referencial utilizado para a constante de ionização é da ordem de 10-5.
Assim, como o Ki envolve uma divisão, se o resultado é um número alto, podemos realizar as seguintes generalizações:
-
As concentrações do numerador são maiores do que as do denominador;
-
Para o numerador ter maior valor, é necessária a presença de muitos íons na solução, logo, trata-se de um ácido ou de uma base que se ioniza muito;
-
Indica ácidos e bases fortes;
-
Indica que o equilíbrio tende sempre para o lado dos íons, o lado direito.

Equação indicando a prevalência da reação direta por ser um eletrólito forte
b) Valor baixo para Ki
Para afirmar que o resultado do cálculo da constante de ionização é baixo, utilizamos a referência da ordem de 10-5.
Assim, como o Ki envolve uma divisão, se o resultado é um número baixo, podemos realizar as seguintes generalizações:
-
As concentrações do numerador são maiores do que as do denominador;
-
Para o numerador ter maior valor, é necessária a presença de muitos íons na solução, logo, trata-se de um ácido ou de uma base que se ioniza pouco;
-
Indica ácidos e bases fracas;
-
Indica que o equilíbrio tende sempre para o lado do eletrólito (ácido ou base), o lado esquerdo.

Equação indicando a prevalência da reação inversa por ser um eletrólito fraco
OBS.: Caso um ácido ou base sofra ionização parcial, cada etapa da ionização apresentará uma constante de ionização.
Videoaulas relacionadas: