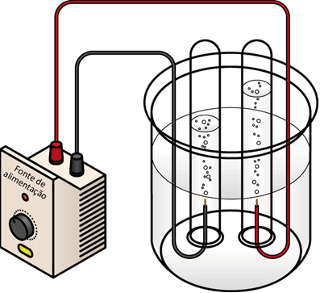
As pilhas e a eletrólise são os dois objetos de estudo da Eletroquímica. O processo da eletrólise e o funcionamento das pilhas possuem alguns aspectos semelhantes e outros totalmente contrários. Consideremos estes aspectos:
Aspectos contrários:
- Uma pilha é um dispositivo que consegue transformar energia química em energia elétrica por meio de uma reação de oxirredução.
Já na eletrólise ocorre o contrário, a energia elétrica é transformada em energia química, pois uma corrente elétrica contínua faz com que os cátions recebam elétrons e os ânions doem elétrons, sendo que dessa forma os íons ficam com carga elétrica igual a zero e com energia química acumulada;
- Na pilha ocorre um processo espontâneo, pois se ligam dois eletrodos por meio de fios condutores de eletricidade e internamente tem a ponte salina que propicia o contato iônico. Assim, o eletrodo que for formado pelo metal mais reativo, isto é, que tem uma maior tendência para se oxidar, irá perder elétrons que serão transferidos para o outro eletrodo.
No caso da eletrólise, o processo é não espontâneo, pois é preciso se aplicar uma corrente elétrica por meio de um sistema líquido contendo íons a fim de iniciar as reações de oxirredução. Usa-se uma fonte de corrente contínua, que geralmente é a própria pilha;
- Conforme dito no item anterior, um dos eletrodos sofre oxidação, liberando elétrons; ele se torna então o polo negativo da pilha, que é chamado de ânodo. E o polo positivo, que recebe os elétrons, sofrendo redução, é o cátodo.
Na eletrólise é o inverso, o ânodo é o polo positivo e o cátodo é o polo negativo. Isso acontece porque o polo negativo da pilha usada para gerar a corrente elétrica fornece elétrons para um dos eletrodos, que se torna negativamente carregado. Dessa forma, ele passa a atrair os íons positivos da solução líquida (cátions), por isso, ele é chamado de cátodo.
Como o circuito está fechado, o outro eletrodo passa a perder os elétrons e fica carregado positivamente, atraindo os íons negativos da solução (ânions) e, dessa forma, é chamado de ânodo.
Resumidamente, temos:

Aspecto similar:
- Ambos os processos envolvem reações de oxirredução;
- Tanto no caso da pilha como no caso na eletrólise, o ânodo é sempre o eletrodo no qual ocorre a reação de oxidação e o cátodo é sempre aquele no qual irá ocorrer a reação de redução, independente do sinal;
- Há uma diferença de potencial entre os eletrodos. Além disso, no caso da eletrólise, a pilha usada para gerar a corrente elétrica deve fornecer uma diferença de potencial igual ou maior que a que é exigida pela reação eletrolítica global.
Aproveite para conferir a nossa videoaula relacionada ao assunto: