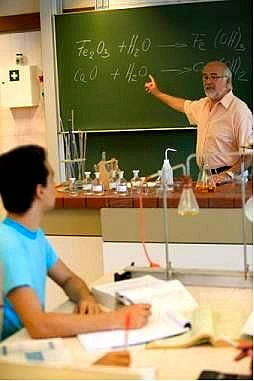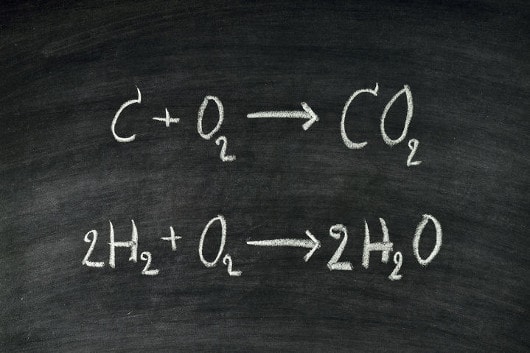Ao realizar o balanceamento das equações químicas, na análise de fórmulas químicas, no cálculo do Nox (número de oxidação) dos elementos em uma molécula e ao trabalhar com cálculos estequiométricos, é muito importante entender o que são os coeficientes e os índices.
A fórmula molecular de uma substância indica quais elementos químicos realizam a ligação, por meio de seus símbolos, e quantos átomos de cada elemento formam uma molécula, por meio de índices. Os índices são números subscritos do lado direito do símbolo do elemento.
Por exemplo, temos que a fórmula de uma molécula de dióxido de carbono pode ser expressa por: CO2. O índice do carbono é 1, que não é escrito, e o índice do oxigênio é 2. Isso significa que na formação de uma molécula dessa substância há um átomo de carbono ligado a dois átomos de oxigênio:

Explicação para uso de índices em fórmula molecular
Os índices podem também aparecer depois e dentro dos parêntesis, como ocorre no caso do fosfato de sódio: Ca3(PO4)3. Nessa fórmula, há:

Cálculo da quantidade de átomos dos elementos na fórmula do fosfato de cálcio
Já o coeficiente estequiométrico é o número que fica à esquerda da fórmula da substância em uma equação química. Ele indica quantas daquela fórmula estão reagindo e, quando a reação está balanceada, indica a proporção estequiométrica.
Por exemplo, considere a seguinte equação balanceada:
2 Al (OH)3 + 3 H2SO4 → 1 Al2(SO4)3 + 6 H2O
Os coeficientes dessa equação são 2, 3, 1 e 6, sendo essa também a proporção com que as substâncias reagem e são formadas ( 2 : 3 : 1 : 6) respectivamente. O coeficiente 1 também não precisa ser escrito, é opcional.
Agora peguemos uma das substâncias mostradas, o hidróxido de alumínio, e vejamos o que o índice indica:

Relação entre índices e coeficientes em uma equação
Videoaula relacionada: