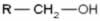O grupo funcional cetona tem como característica principal a presença de um carbono secundário conectado, por dupla ligação, a um oxigênio; é bem semelhante ao grupo aldeído, que tem em seus compostos a carbonila na extremidade da cadeia.
As cetonas são aplicadas industrialmente como solventes, são compostos inflamáveis, reativos, e nelas características como densidade e solubilidade variam conforme o tamanho da cadeia carbônica.
Leia também: Quais são as possíveis classificações do carbono?
Tópicos deste artigo
- 1 - Estrutura das cetonas
- 2 - Propriedades das cetonas
- 3 - Classificação das cetonas
- 4 - Nomenclatura das cetonas
- 5 - Aplicação das cetonas
- 6 - Principais cetonas
- 7 - Síntese e formas de obtenção das cetonas
- 8 - Diferença entre aldeídos e cetonas
- 9 - Exercícios resolvidos
Estrutura das cetonas
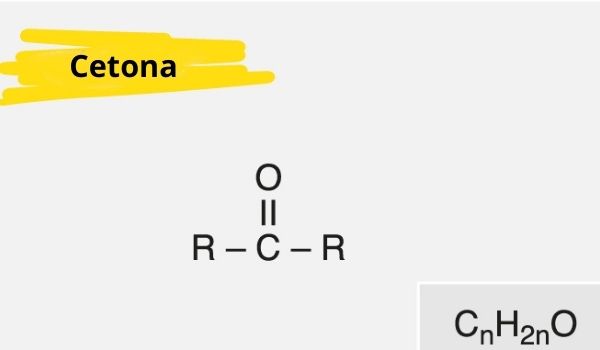
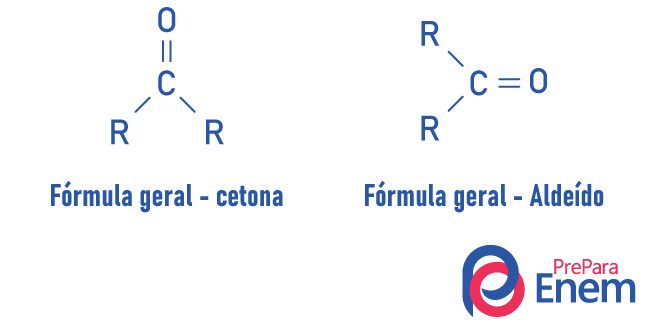
Uma cetona é caracterizada pela presença de uma carbonila (oxigênio conectado a um carbono com dupla ligação) ligada a um carbono secundário (carbono ligado a outros dois carbonos).
A fórmula geral para cetona é: R — C (= O) — R.
Propriedades das cetonas
Os pontos de fusão e ebulição das moléculas variam conforme o tamanho da cadeia carbônica. No entanto, devemos saber quem as moléculas de cetonas são ligadas por força de interação dipolo-dipolo, ou seja, de modo não tão forte, por isso não será necessária tanta energia para desconectar-se as moléculas e, consequentemente, o ponto de ebulição não será tão alto.
A propanona, por exemplo, nossa famosa acetona, menor molécula da função cetona, tem ponto de ebulição 53 °C, pouco maior que a temperatura ambiente, isso explica a volatilidade do composto (facilidade que a acetona tem de passar para o estado gasoso).
Os compostos da função cetona são levemente polares, devido à diferença de eletronegatividade provocada pelo oxigênio, e são substâncias incolores e inflamáveis. O tamanho da cadeia carbônica da cetona determina a solubilidade do composto em água: quanto maior o número de carbonos do composto, menos solúvel ele será em água e mais solúvel ele será em solventes orgânicos.
Classificação das cetonas
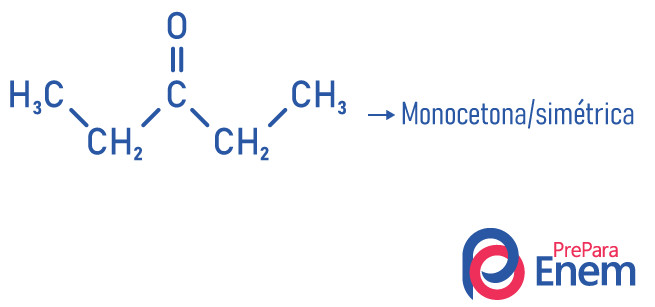
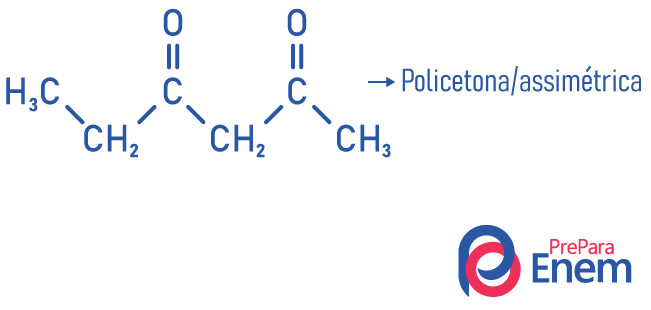
As cetonas podem ser classificadas de duas formas de acordo com a simetria da molécula, são elas:
-
simétricas: quando os radicais ligados à carbonila são iguais;
-
assimétricas: quando os radicais são diferentes.
A outra classificação para compostos do grupo cetona ocorre de acordo com o número de carbonilas:
-
monocetona: quando se tem apenas uma carbonila;
-
policetona: quado se tem duas ou mais carbonilas.
Exemplos:
Leia também: Classificação dos alcoóis – quais são os critérios?
Nomenclatura das cetonas
A nomenclatura para o grupo das cetonas segue as regras estipuladas pela União Internacional de Química Pura e Aplicada (Iupac) e tem a terminação -ona, característica do grupo funcional cetona. Lembrando que a nomenclatura para cadeira carbônica tem regras para ordenação e nome dos radicais: o prefixo ocorre de acordo com o número de carbonos da cadeia principal, e o infixo, de acordo com a saturação da cadeia:
|
Prefixo (nº de carbonos) |
Infixo (saturação da cadeia) |
Sufixo (grupo funcional) |
|||
|
1 carbono |
Met- |
Apenas ligações simples |
-an- |
Cetona |
-ona |
|
2 carbonos |
Et- |
||||
|
3 carbonos |
Prop- |
1 ligação dupla |
-en- |
||
|
4 carbonos |
But- |
||||
|
5 carbonos |
Pent- |
2 ligações duplas |
-dien- |
||
|
6 carbonos |
Hex- |
||||
|
7 carbonos |
Hept- |
1 ligação tripla |
-in- |
||
|
8 carbonos |
Oct- |
||||
|
9 carbonos |
Non- |
2 ligações triplas |
-diin- |
||
|
10 carbonos |
Dec- |
||||
Atenção! Quando houver mais de uma posição possível para a carbonila, deve-se indicar qual o carbono em que ela se encontra, a mesma regra vale para ramificações e insaturações. A contagem de carbonos é feita com base no carbono mais próximo do grupo funcional.
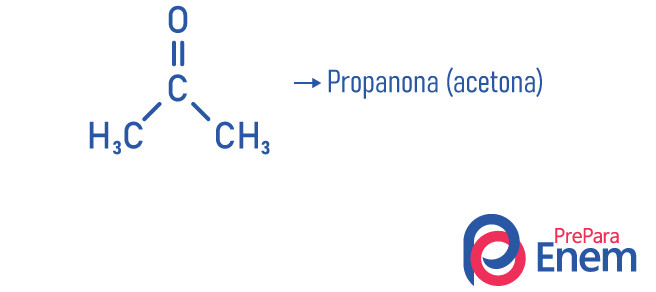
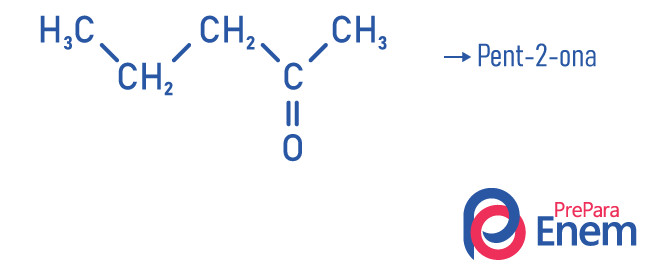
Exemplos
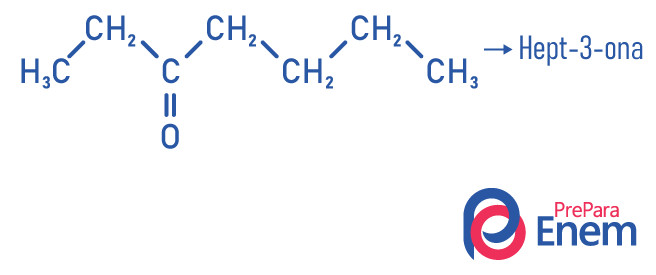
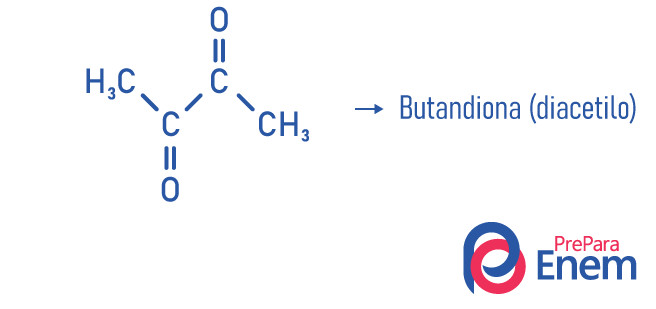
Aplicação das cetonas
As cetonas são usadas principalmente como solvente para tintas, esmaltes, vernizes e também para o processo de extração de óleos naturais de sementes.
Exemplos:
-
Propanona ou acetona (C3H6O): removedora de esmaltes.
-
Butanona (C4H8O): solvente industrial utilizado na produção de gomas, resinas, revestimentos, entre outros.
-
Hept-2-ona (C7H14O): responsável pelo odor de algumas frutas.
-
Acetofenona (C8H8O): utilizada pela indústria de cosméticos na preparação de fragrâncias.
-
Zingerone ou 4-(4-hidroxi-3-metoxifenil)-butan-2-ona (C11H14O3): principal responsável pelo sabor do gengibre.

Principais cetonas
-
Propanona (acetona): menor composto da função cetona, é utilizada como removedor e solvente de esmaltes; encontra-se a condições normais de temperatura e pressão na forma líquida; possui densidade de 58.08 g/mol e ponto de fusão de -95 °C; e é uma substância inflamável, volátil e solúvel em água. É obtida por meio da desidrogenação do isopropanol.

-
Butanona: segundo menor composto da função cetona, é utilizada como solvente industrial; possui odor doce; e é um composto isômero do butiraldeído. É um solvente aplicável a várias substâncias: tintas, vernizes, cola; e é utilizada em indústrias têxteis e na fabricação de borracha sintética.
Acesse também: Onde encontramos éteres no cotidiano?
Síntese e formas de obtenção das cetonas
As cetonas podem ser sintetizadas por diversos tipos de reações, vejamos aqui algumas delas:
-
Cetonas por hidratação de alcinos
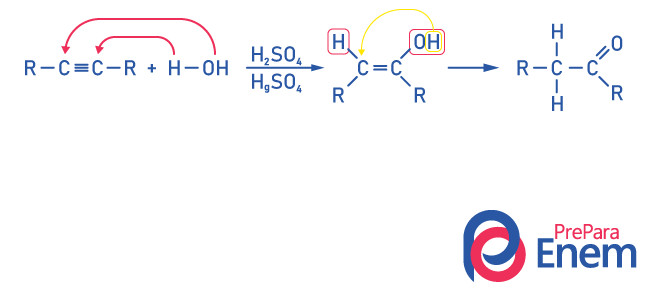
Para a obtenção de um composto do grupo cetona, como produto dessa reação é necessário que o alcino tenha mais que dois carbonos, pois, quando a reação é feita com o etino, o produto final será um aldeído, não uma cetona.
Perceba que temos um álcool como produto intermediário, e, obedecendo à regra de Markovnikov, o hidrogênio da hidroxila migra para o carbono vizinho, que é mais hidrogenado. Esse rearranjo é chamado de tautomerização ceto-enol, formando-se, assim, uma cetona.
-
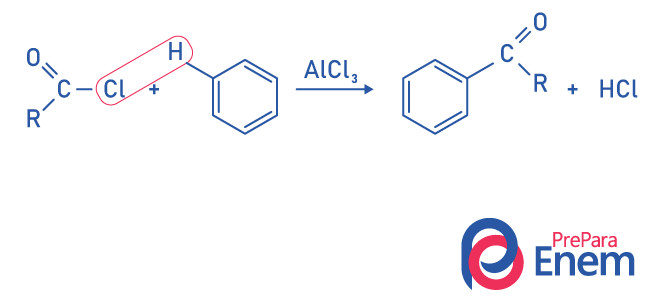
Cetonas por reação de acilação de Friedel-Crafts
A acilação é uma reação de substituição que ocorre em um anel aromático, com a substituição de um dos hidrogênios pelo grupo “acil” (cloreto de ácido). Para que ocorra essa reação, utiliza-se o cloreto ferríco (FeCl3), um ácido de Lewis que contribuirá com a quebra da ligação entre o carbono e o halogênio do grupo ácil, unindo o cloro ao catalisador, e a substituição acontece formando-se uma cetona aromática.
-
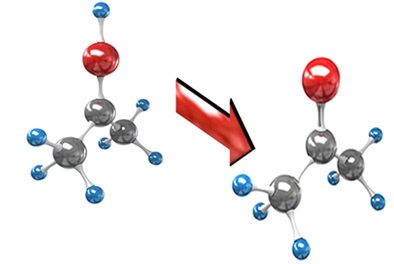
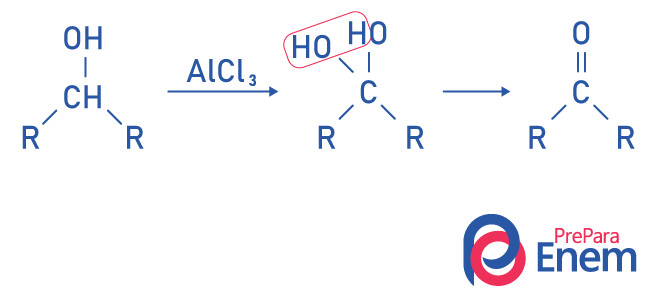
Cetonas por oxidação de álcool secundário (hidroxila ligada a um carbono secundário)
Nesse caso acontece a oxidação do carbono secundário onde está ligada a hidroxila, característica do grupo funcional álcool. Daí o produto intermediário formado será um diálcool, molécula do grupo álcool com duas hidroxilas que se recombinam, formando-se uma cetona e uma molécula de água.
Para que a reação ocorra, é necessário usar um agente oxidante, como dicromato de potássio (K2Cr2O7), permanganato de potássio (KMnO4) ou ácido crômico (H2CrO4).
Diferença entre aldeídos e cetonas
Aldeídos e cetonas são compostos muito parecidos, compartilhando propriedades como solubilidade e densidade. A diferença entre as duas funções está no posicionamento da carbonila.
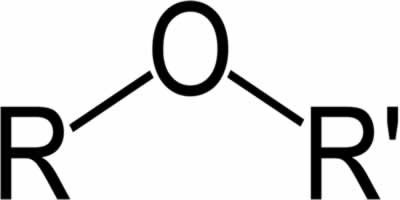
Substâncias da função cetona têm o oxigênio conectado, com uma dupla ligação, a um carbono secundário. No caso de aldeídos, a carbonila está ligada à extremidade da molécula. Análogo a isso, os aldeídos são moléculas mais reativas que as cetonas, pois não sofrem o efeito estérico tão intenso quanto ocorre na cetona pela presença dos radicais, e o carbono do grupo aldeído, por ter um hidrogênio substituinte, sofre efeito indutivo, ficando propenso a reagir com outras moléculas.
Exercícios resolvidos
Questão 1 – (UFMG) Cetonas macrocíclicas são usadas em perfumes porque possuem intenso cheiro de almíscar e retardam a evaporação de constituintes mais voláteis.
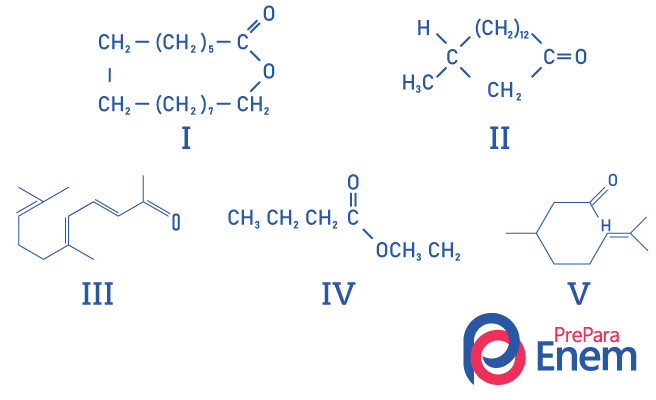
A identificação CERTA das estruturas de substâncias com cheiro de almíscar é:
A) I, II, III, IV e V.
B) II, III e V.
C) I e II.
D) I e IV.
E) II.
Resolução
Alternativa E, pois apenas o composto II possui o grupo funcional cetona, os demais compostos são: I- éster; III- aldeído; IV- éster; V- aldeído.
Questão 2 – (FGV-SP–2007) O gengibre é uma planta da família das zingiberáceas, cujo princípio ativo aromático está no rizoma. O sabor ardente e acre do gengibre vem dos fenóis gingerol e zingerona.
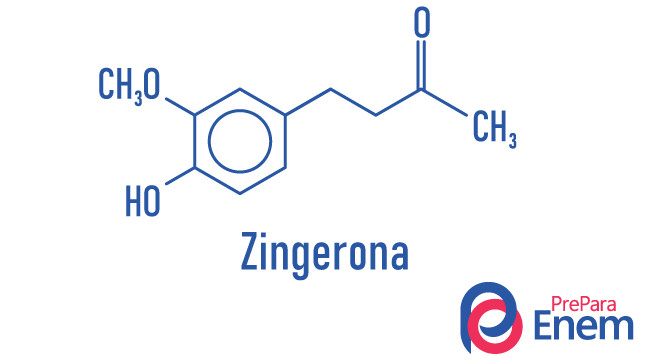
Na molécula de zingerona, são encontradas as funções orgânicas:
A) álcool, éter e éster.
B) álcool, éster e fenol.
C) álcool, cetona e éter.
D) cetona, éter e fenol.
E) cetona, éster e fenol.
Resolução
Alternativa D. Observando a molécula da esquerda para a direita, a primeira função orgânica encontrada é a cetona, que tem uma carbonila entre radicais orgânicos; depois, temos o éter, que se caracteriza pelo oxigênio entre carbonos; e, em seguida, temos o grupo fenol, que se caracteriza pela hidroxila ligada a um anel aromático.