A água oxigenada é uma solução de peróxido de hidrogênio (H2O2) que, com o tempo, sofre uma reação de decomposição, liberando os gases oxigênio e hidrogênio:
H2O2(aq) → H2O(l) + O2(g)
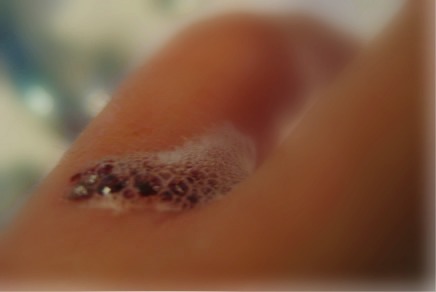
Essa reação ocorre de forma bem lenta. Todavia, quando colocamos a água oxigenada de 10 volumes em um machucado, notamos uma grande efervescência, que é a mesma reação de decomposição mostrada acima, só que muito mais rápida. O que acelerou essa reação? Uma enzima presente no sangue chamada catalase.

A formação de bolhas que é observada quando se coloca água oxigenada em machucado é resultado da atuação da enzima catalase
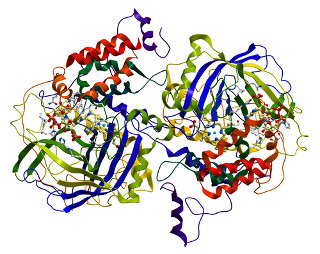
As enzimas são proteínas de grande massa molar, sendo constituídas por longas cadeias de aminoácidos unidas por ligações peptídicas e articuladas em estruturas tridimensionais (veja como essas cadeias realmente são grandes na ilustração da enzima catalase no início deste artigo). As enzimas também são chamadas de catalisadores biológicos ou biocatalisadores.
Conforme explicado no texto Catalisadores, uma catálise é uma reação química em que há presença de catalisadores. Estes, por sua vez, são substâncias capazes de aumentar a velocidade de determinadas reações sem participar delas, ou seja, são totalmente reconstituídas no final. Assim, as enzimas são catalisadoras porque aumentam a velocidade de reações bioquímicas que ocorrem em nosso organismo.
Qualquer catálise ocorre porque os catalisadores fornecem um novo caminho para a reação, um caminho que necessita de uma energia de ativação menor. Eles unem-se ao reagente para formar um composto intermediário, que depois se transforma, originando o produto e regenerando o catalisador (isso pode ser visto em mais detalhes no texto Catálise Homogênea).
As enzimas atuam dessa forma, pois elas se combinam com uma molécula (substrato) e, através de uma baixa energia de ativação, formam uma estrutura intermediária, que, em seguida, decompõe-se facilmente, formando o produto e regenerando a enzima.
Esse mecanismo de ação das enzimas é chamado de chave-fechadura e foi proposto em 1894 pelo químico alemão Hermann Fischer (1852-1919). Assim como uma chave tem o formato específico para determinada fechadura, as enzimas possuem regiões específicas (sítios ativos) para que o substrato se encaixe. É por isso que as enzimas são altamente específicas, isto é, cada uma acelera somente uma etapa específica das vias bioquímicas envolvidas na formação de um determinado produto. A atividade das enzimas é controlável e seletiva.
O esquema a seguir nos ajuda a entender como a hipótese “chave-fechadura” explica o mecanismo de ação das enzimas:

Esquema de funcionamento das enzimas baseado no modelo chave-fechadura
Assim, as enzimas atuam no metabolismo celular convertendo nutrientes como carboidratos, proteínas e gorduras em substâncias que podem ser absorvidas e usadas pelas células. Por isso, elas são tão importantes para nossas vidas.
Um exemplo de catálise enzimática que ocorre no interior das hemácias é a realizada pela enzima anidrase carbônica. O gás carbônico (CO2) é transportado dentro de nosso corpo 70% das vezes dissociado em HCO3-. Para tal, o CO2 reage com a água, formando o ácido carbônico, H2CO3, que se dissocia nos íons HCO3- e H+. Mas essa reação demora alguns segundos. Por outro lado, dentro das hemácias, a anidrase carbônica converte instantaneamente o gás carbônico em ácido carbônico, acelerando essa reação cerca de 5 mil vezes!