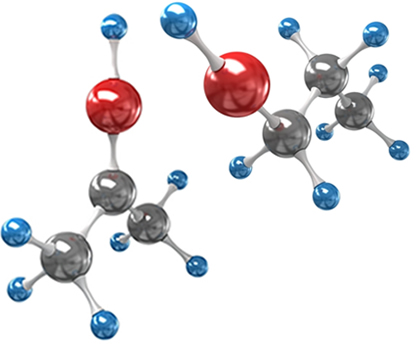
Uma estrutura simétrica é aquela que possui pelo menos um plano de simetria, ou seja, que se for dividida produzirá duas metades idênticas. Por exemplo, se uma raquete de tênis for dividida ao meio, as duas partes serão exatamente iguais.

Já uma estrutura assimétrica é aquela que não apresenta nenhum plano de simetria. Alguns objetos que são assim são as nossas mãos, um par de sapatos, um par de luvas, etc. Esses materiais possuem estruturas geométricas opostas e não sobreponíveis, isto é, se colocarmos uma sobre a outra, elas não coincidem.
Na figura abaixo, a imagem da mão direita refletida no espelho tem a mesma forma da mão esquerda. Além disso, se tentarmos superpor a mão direita sobre a esquerda, veremos que os polegares ficam em lados opostos.

A condição necessária para a ocorrência de isomeria óptica é que a molécula da substância seja assimétrica. Um modo de verificar se a molécula de determinado composto orgânico é assimétrica é observar se ela possui átomo de carbono assimétrico.
Um átomo de carbono assimétrico é aquele que possui quatro ligantes diferentes entre si.
Genericamente, temos:
G3
|
G1 ─ C* ─ G2 onde G1 ≠ G2 ≠ G3 ≠ G4
|
G4
O carbono assimétrico costuma ser indicado na estrutura por um asterisco (*). Esse carbono assimétrico também é chamado de carbono quiral, que é uma palavra que se origina de khéir, que em grego significa mão (com base na explicação feita acima).
Na figura abaixo temos um exemplo. Veja que a molécula 1 é a imagem especular da molécula 2, e que elas não são sobreponíveis.

É importante ressaltar que não olhamos somente os 4 átomos imediatamente ligados ao carbono, mas sim as 4 estruturas.
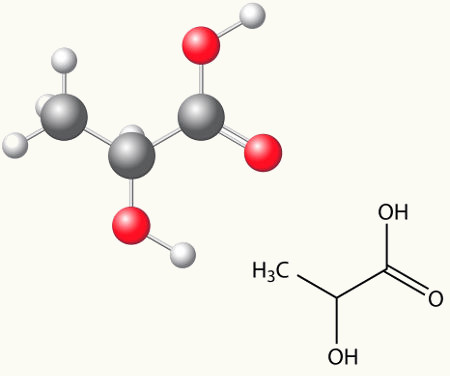
Um exemplo real que nos mostra isso é o ácido lático (ácido-2-hidróxi-propanoico) encontrado tanto no leite azedo quanto nos músculos. Sua fórmula estrutural plana está representada a seguir:
OH
|
H3C ─ C* ─ COOH
|
H
Veja que seus quatro ligantes são diferentes. Além disso, por ter em sua estrutura um carbono assimétrico (quiral), ele possui dois isômeros que são a imagem especular um do outro, sendo chamados de enantiômeros.
A figura a seguir mostra que esses dois enantiômeros guardam entre si uma relação objeto-imagem especular de modo que não podem ser sobrepostas.

Os dois enantiômeros do ácido lático são opticamente ativos, sendo então chamados também de enantimorfos (do grego enantios, que significa oposto; e morphos, que é forma; isto é, ‘formas opostas’) ou antípodas ópticos, pois ambos desviam o plano de luz polarizada com um mesmo ângulo, mas em sentidos opostos.
Possuir um carbono quiral resulta em um deles desviar o plano de luz polarizada para a direita, sendo chamado de isômero dextrógiro (d) (do latim dexter, direito); enquanto que o outro desvia para a esquerda, sendo designado de isômero levógiro (l) (do latim laevus, esquerdo).
Conforme a tabela abaixo, os dois ácidos láticos têm todas as propriedades físicas e químicas iguais, exceto as propriedades fisiológicas por causa da diferença no desvio do plano da luz polarizada: