Veremos neste texto como resolver questões em estequiometria em que a pergunta pede que o resultado seja dado em número de partículas (moléculas, íons, elétrons, fórmulas unitárias ou átomos), ou o contrário, em que o dado é expresso em número de partículas.
Assim como em todo cálculo estequiométrico, o primeiro ponto a ser feito é escrever a equação química devidamente balanceada e analisar a proporção estequiométrica, que é dada pelos coeficientes (números que aparecem antes de cada substância e espécie química que participa da reação). Esses coeficientes são os mesmos valores que os números de mol.
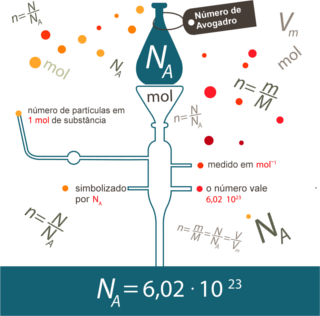
Depois é preciso relacionar o número de mol com o valor da constante de Avogadro. No texto Mol e Constante de Avogadro, mostrou-se que 1 mol representa um número – 6,022 . 1023, que é o valor da constante de Avogadro.
.jpg)
Além disso, em muitos exercícios desse tipo, será preciso relacionar a massa das substâncias com o número de mol por meio da massa molecular ou massa atômica. Se tivermos uma massa em gramas numericamente igual à massa atômica, para qualquer elemento, existem 6,02 . 1023 átomos. O mesmo vale para a massa molecular das substâncias.
Por exemplo, a massa molecular da água é 18 u, então, se tivermos 18 g de água, significa que temos exatamente 6,02 . 1023 moléculas de H2O.
Veja os exemplos abaixo para entender melhor como aplicar essas informações:
Exemplo 1: Qual a quantidade de moléculas de gás oxigênio necessária para fornecer 17,5 mol mol de água, H2O, na queima completa do acetileno, C2H2?
Resolução:
Primeiro escrevemos a equação balanceada:
2 C2H2 + 5 O2 → 4 CO2 + 2 H2O
↓ ↓
5 mol 2 mol
5 mol------- 2mol
x------------ 17,5 mol
x = 43,75 mol de O2
1 mol------- 6 . 1023 moléculas
43,75 mol ------- x
x = 262,5 . 1023 moléculas de O2
Exemplo 2: (UFPE) Nas usinas siderúrgicas, a obtenção de ferro metálico a partir da hematita envolve a seguinte reação (não balanceada):
Fe2O3 + CO → Fe + CO 2
Percebe-se desta reação que o CO2 é liberado para atmosfera, podendo ter um impacto ambiental grave relacionado com o efeito estufa. Qual o número de moléculas de CO2 liberadas na atmosfera, quando um mol de óxido de ferro (III) é consumido na reação? Considere: número de Avogadro igual a 6 . 1023 mol-1:
a) 6 x 1023
b) 24 . 1023
c)12 . 1023
d)36 . 1023
e)18 . 1023
Resolução:
Equação balanceada:
1 Fe2O3 + 3 CO → 2 Fe + 3 CO 2
↓ ↓
1 mol 3 mol
1 mol------- 6 . 1023 moléculas
3 mol ------- x
x = 18 . 1023 moléculas de CO2
Alternativa “e”.
Exemplo 3: (UFF-RJ) Em relação à produção de fosfato de sódio por meio da reação do ácido fosfórico com um excesso de hidróxido de sódio, pede-se:
a) a equação balanceada para a reação.
b) a quantidade, em gramas, de fosfato de sódio produzido ao se utilizar 2,5 . 1023 moléculas de ácido fosfórico . (Dado: Massas Molares em g/mol: Na=23, P=31 e O=16)
Resolução:
a) H3PO4 + 3 NaOH → Na3PO4 + 3 H2O
b) Pela equação balanceada vemos que 1 mol de ácido fosfórico resulta em 1 mol de fosfato de sódio.
1 mol ----- 6,0 . 1023
x----------- 2,5 . 1023
x = 0,416 mol
- Calculando a massa molecular (MM) do fosfato de sódio:
MM = 3 . 23 + 1 . 31 + 4 . 16 = 164 g/mol
1 mol -------- 164 g
0,416 mol------y
y = 68,3 g de fosfato são produzidos.
Videoaula relacionada: