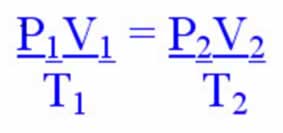Os cálculos com a equação de Clapeyron são procedimentos matemáticos muito utilizados, com o objetivo de determinar uma das seguintes variáveis:
-
Pressão do sistema;
-
Volume do sistema;
-
Número de mol ou quantidade de matéria;
-
Massa molar da substância;
-
Massa da substância presente no sistema;
-
Temperatura do sistema.
A seguir, conheça situações e cálculos que exemplificam a uso da equação de Clapeyron.
Cálculo da temperatura com a equação de Clapeyron
Exercícios que pedem a temperatura de um sistema, utilizando a equação de Clapeyron, geralmente fornecem dados como pressão, volume, número de mol ou massa do material, como podemos observar no seguinte exemplo:
Exemplo (Uefs-BA) Um recipiente de 24,6L contém 1,0 mol de nitrogênio exercendo a pressão de 1,5 atm. Nessas condições, a temperatura do gás, vale, na escala Kelvin:
a) 30 b) 40 c) 45 d) 300 e) 450
Os dados fornecidos pelo exercício foram:
-
Volume do recipiente = 24,6 L
-
Número de mol do N2 = 1 mol
-
Pressão = 1,5 atm
-
Temperatura do gás = ?
-
R = 0,082 (porque a pressão está em atm)
Assim, basta utilizar todos esses dados na equação de Clapeyron, sendo que a temperatura deve ser calculada na unidade Kelvin:
P.V = n.R.T
1,5.24,6 = 1.0,082.T
36,9 = 0,082.T
T = 36,9
0,082
T = 450 K
Cálculo do volume de um componente com o uso da equação de Clapeyron
Exercícios que pedem essa variável, utilizando a equação de Clapeyron, geralmente fornecem dados como pressão, temperatura, número de mol ou massa do material, como no exemplo a seguir:
Exemplo (UFPI) O octano, C8H18, é um dos constituintes da gasolina. Quando você dirige um automóvel, ocorre a sua queima através da reação de combustão. Considerando uma combustão completa, encontre o volume de oxigênio, O2, puro, à pressão de 1,025 atm, e 27 ºC, para queimar 57 g de octano.
a) 100 litros b) 240 litros c) 180 litros d) 150 litros e) 15 litros
Os dados fornecidos pelo exercício foram:
-
Pressão = 1,025 atm
-
Temperatura = 300 K (como o exercício forneceu temperatura em oC, e na equação de Clapeyron deve ser utilizada em Kelvin, deve-se somar 273)
-
Massa de octano = 57 g
Para encontrar o volume do gás oxigênio, devemos realizar os seguintes passos:
-
1º Passo: Calcular a massa molar do octano.
Para isso, basta multiplicar a massa do elemento pela sua massa atômica e, em seguida, somar os resultados:
M = 8.12 + 18.1
M = 96 + 18
M = 114 g/mol
-
2º Passo: Calcular o número de mol do butano.
Deve ser feita a divisão da massa pela sua massa molar:
n = m
M
n = 57
114
n = 0,5 mol de octano
-
3º Passo: Montar e balancear a equação de combustão do octano.
C8H18 + 25/2 O2 → 8 CO2 + 9 H2O
-
4º Passo: Calcular o número de mol de gás oxigênio a partir da equação de combustão e do número de mol do octano.
1 C8H18-------25/2 O2
1 mol-------- 12,5 mol
0,5 mol-------x
x = 0,5.12,5
x = 6,25 mol de O2
-
5º Passo: Calcular o volume de O2 utilizando a pressão e temperatura fornecidas, junto com o número de mol obtido no quarto passo, na equação de Clapeyron.
P.V = n.R.T
1,025.V = 6,25.0,082.300
1.025V = 153,75
V = 153,75
1,025
V = 150 L
Cálculo da pressão do sistema a partir da equação de Clapeyron
Exercícios que pedem a pressão de um sistema, utilizando a equação de Clapeyron, geralmente fornecem dados como volume, temperatura, número de mol ou massa do material, como no seguinte exemplo:
Exemplo (ITA-SP) Num garrafão de 3,5 L de capacidade, contendo 1,5 L de solução 1,0 molar de ácido sulfúrico, introduzem-se 32,7 g de aparas de zinco; fecha-se rapidamente com rolha de borracha. Supondo que a temperatura do ambiente onde esta perigosa experiência está sendo feita seja de 20 ºC, o incremento máximo de pressão interna (P) do frasco será de:
a) 0,41 atm. b) 3,4 atm. c) 5,6 atm d) 6,0 atm. e) 12,0 atm.
Dados fornecidos pelo exercício:
-
Volume do garrafão = 3,5 L
-
Volume de ácido = 1,5 L
-
Concentração molar do ácido = 1 mol/L
-
Massa do zinco = 32,7 g
-
Temperatura = 293 K (a temperatura estava em oC e, na equação de Clapeyron, deve ser utilizada em Kelvin)
Para determinar o incremento de pressão, devemos realizar os seguintes passos:
-
1º Passo: Calcular o número de mol do ácido. Para isso, basta multiplicar seu volume por sua concentração molar.
nH2SO4 = 1,5.1
nH2SO4 = 1,5 mol
-
2º Passo: Calcular o número de mol do zinco. Para isso, devemos dividir sua massa pela massa molar, que é 65,5 g/mol:
nZn = 32,7
65,5
nZn = 0,5 mol
-
3º Passo: Montar e balancear a equação do processo.
1 H2SO4 + 1 Zn → 1 ZnSO4 + 1 H2
-
4º Passo: Determinar o número de mol de ácido que reage com o zinco.
De acordo com a equação balanceada:
1 H2SO4 + 1 Zn
1mol-------1 mol
1 mol de ácido reage com 1 mol de zinco, ou seja, a quantidade mol de um é exatamente igual à do outro. Nos dois primeiros passos, calculamos o número de mol de cada um dos componentes que foi utilizado:
1 H2SO4 + 1 Zn
1 mol-------1 mol
1,5-------0,5mol
Portanto, há 1 mol de ácido (H2SO4) em excesso.
-
5º Passo: Determinar o número de mol de gás hidrogênio produzido pela reação.
Obs.: Esse cálculo deve ser efetuado porque o hidrogênio é o gás produzido na reação.
Como todos os participantes da equação apresentam o coeficiente 1, e no quarto passo descobrimos que o número de mol de cada reagente é 0,5 mol, logo o número de mol de cada produto também é 0,5 mol.
1 H2SO4 + 1 Zn → 1 ZnSO4 + 1 H2
0,5 mol----0,5 mol----0,5 mol----0,5mol
-
6º Passo: Determinar a pressão, utilizando o número de mol do H2 encontrado no passo anterior, o volume e a temperatura fornecidos pelo enunciado:
P.V = n.R.T
P.3,5 = 0,5.0,082.293
P.3,5 = 12,013
P = 12,013
3,5
P = 3,43
Cálculo da quantidade de matéria a partir da equação de Clapeyron
Exercícios que pedem a quantidade de matéria (número de mol) de um material, utilizando a equação de Clapeyron, geralmente fornecem dados como volume, temperatura, pressão, como no exemplo a seguir:
Exemplo (UFSE-SE) Que quantidade de amônia (NH3) é necessária para substituir todo o ar contido em um recipiente de 5,0 L, aberto e sob condições ambientais de pressão e temperatura?
a) 5,0 mol b) 2,0 mol c) 1,0 mol d) 0,20 mol e) 0,10 mol
Dados fornecidos pelo exercício:
-
Fórmula da amônia = NH3
-
Volume = 5 L
-
Pressão em condições ambientais = 1 atm
-
Temperatura em condições ambientais = 298 K (a temperatura em condições ambientais é de 25 oC. Na equação de Clapeyron, ela deve ser utilizada em Kelvin)
A determinação do número de mol ou quantidade de matéria de NH3 contido no recipiente será realizada utilizando os dados fornecidos na equação de Clapeyron:
P.V = n.R.T
1.5 = n.0,082.298
5 = n.24,436
n = 5
24,436
n = 0,204 mol (aproximadamente)
Cálculo da massa do material a partir da equação de Clapeyron
Exercícios que pedem a massa de um material, utilizando a equação de Clapeyron, geralmente fornecem dados como volume, temperatura e pressão, como no exemplo a seguir:
Exemplo (Unimep-SP) A 25 ºC e a 1 atm, dissolvem-se 0,7 litros de gás carbônico em um litro de água destilada. Essa quantidade de CO2 corresponde a: (Dados: R = 0,082 atm.l/mol.k; Massas atômicas: C = 12; 0 = 16).
a) 2,40 g b) 14,64 g c) 5,44 g d) 0,126 g e) 1,26 g
Os dados fornecidos pelo exercício foram:
-
Pressão = 1,0 atm
-
Temperatura = 298 K (como a temperatura foi fornecida em oC e deve ser utilizada em Kelvin na equação de Clapeyron, soma-se 273 a ela)
-
Volume de CO2 = 0,7 L
Para encontrar o volume do gás oxigênio, é necessário realizar os seguintes passos:
-
1º Passo: Calcular a massa molar do CO2. Para isso, devemos multiplicar a massa do elemento pela sua massa atômica e, em seguida, somar os resultados:
M = 1.12 + 2.16
M = 12 + 32
M = 44 g/mol
-
2º Passo: Calcular a massa de CO2 utilizando a pressão e temperatura fornecidas, junto com a massa obtido no segundo passo, na equação de Clapeyron.
P.V = n.R.T
P.V = m .R.T
M
1.0,7 = m.0,082.298
44
0,7.44 = m.24,436
30,8 = m.24,436
m = 30,8
24,436
m = 1,26 g (aproximadamente)
Cálculo da fórmula molecular a partir da equação de Clapeyron
Exercícios que pedem a fórmula molecular de uma substância, utilizando a equação de Clapeyron, geralmente fornecem dados como volume, temperatura, pressão e massa do material, como podemos observar no seguinte exemplo:
Exemplo (Unirio-RJ) 29,0 g de uma substância pura e orgânica, no estado gasoso, ocupam o volume de 8,20 L à temperatura de 127 °C e à pressão de 1520 mmHg. A fórmula molecular do provável gás é: (R = 0,082 l . atm .L/mol K)
a) C2H6 b) C3H8 c) C4H10 d) C5H12 e) C8H14
Os dados fornecidos pelo exercício foram:
-
Pressão = 2 atm (o exercício forneceu uma pressão em mmHg e pede para utilizarmos em atm. Para isso, basta dividir esse valor por 760 mmHg)
-
Massa do material = 29 g
-
Fórmula molecular do material = ?
-
Temperatura = 400 K (a equação de Clapeyron utiliza temperatura em Kelvin, portanto, deve-se somar 273 a ela)
-
Volume de CO2 = 8,2 L
Para encontrar a fórmula molecular, devemos realizar os seguintes passos:
-
1º Passo: Determinar a massa molar da substância.
Para isso, devemos utilizar os dados fornecidos na equação de Clapeyron:
P.V = n.R.T
P.V = m .R.T
M
2.8,2 = 29.0,082.400
M
16,4.M = 951,2
M = 951,2
16,4
M = 58 g/mol (aproximadamente)
2º Passo: Calcular a massa molar de cada composto apresentado no exercício. Para isso, basta multiplicar a massa do elemento por sua massa atômica e, em seguida, somar os resultados:
a- M = 2.12 + 6.1
M = 24 + 6
M = 30 g/mol
b- M = 3.12 + 8.1
M = 36 + 8
M = 44 g/mol
c- M = 4.12 + 10.1
M = 48 + 10
M = 58 g/mol
Logo, a fórmula molecular do composto é o C4H10.