Realizar o cálculo do número de partículas em uma solução é importante porque a quantidade de soluto determina o comportamento físico do solvente com relação ao ponto de fusão, ao ponto de ebulição, à pressão osmótica e à pressão máxima de vapor.
O estudo sobre o cálculo do número de partículas em uma solução ocorreu juntamente com a descoberta das chamadas propriedades coligativas (tonoscopia, ebulioscopia, crioscopia e osmoscopia).
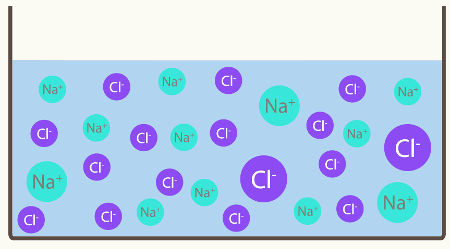
Para calcular o número de partículas em uma solução, devemos levar em consideração a natureza do soluto que foi dissolvido no solvente, ou seja, se ele é iônico ou molecular.
O conhecimento da natureza do soluto é relevante porque os solutos iônicos sofrem o fenômeno da ionização ou dissociação, o que não ocorre com os moleculares. Assim, quando ionizam ou dissociam, o número de partículas na solução sempre será elevado.
Vejamos a seguir alguns passos fundamentais e exemplos de cálculo do número de partículas para soluções que apresentam cada um dos dois tipos de solutos.
Cálculo do número de partículas em uma solução com soluto molecular
A realização do cálculo do número de partículas em uma solução com um soluto molecular leva em consideração dois fatores fundamentais, a massa molar do soluto e a constante de Avogadro (6,02.1023 partículas por mol).
Assim, quando conhecemos o soluto molecular e a massa que foi adicionada ao solvente, podemos calcular o número de partículas desse soluto realizando os seguintes passos:
1º Passo: Calcular a massa molar do soluto.
Para isso, basta multiplicar a massa do elemento pela quantidade de átomos dele na fórmula da substância e, em seguida, somar com os resultados dos outros elementos pertencentes à fórmula.
Exemplo: Cálculo da massa molar da sacarose (C12H22O11), considerando que a massa atômica do C = 12 g/mol; massa atômica do H = 1 g/mol; e massa do O = 16 g/mol.
Massa molar = 12.12 + 1.22 + 11.16
Massa molar = 144 + 22 + 176
Massa molar = 342 g/mol
2º Passo: Montar a regra de três que determinará o número de partículas do soluto na solução.
Nessa regra de três, necessária para calcular o número de partículas da solução, na primeira linha, temos a massa molar e a constante de Avogadro. Na segunda linha, temos a incógnita e a massa do soluto que foi utilizado no preparo da solução.
Exemplo: Qual é o número de partículas em uma solução preparada pela adição de 50 g de sacarose em água?
1ª linha: 342 g-------------6,02.1023 partículas
2ª linha: 50 g------------- x
342.x = 50.6,02.1023
342x = 301.1023
x = 301.1023
342
x = 0,88.1023 partículas, aproximadamente
ou
x = 8,8.1022 partículas, aproximadamente
Cálculo do número de partículas em uma solução com soluto iônico
Para realizar o cálculo do número de partículas de solutos iônicos, devemos seguir o mesmo princípio utilizado no cálculo das soluções moleculares, ou seja, baseando-se na constante de Avogadro (6,02.1023) e na massa molar.
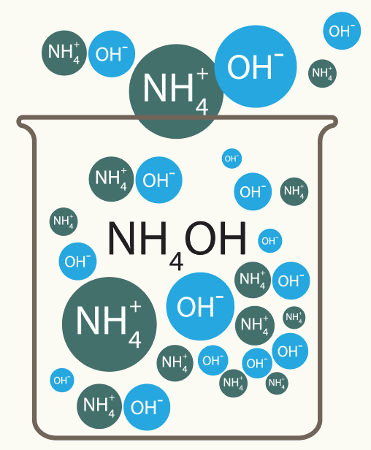
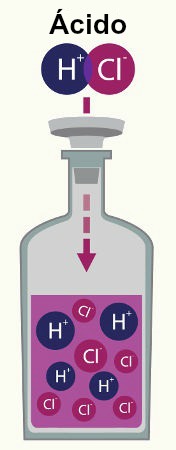
Porém, não podemos esquecer que, quando dissolvido, o soluto iônico ioniza ou dissocia, liberando ou formando íons. Dessa forma, aumenta-se a quantidade de partículas presentes na solução. Essa observação foi realizada pelo químico Van't Hoff, o qual criou um fator para corrigir o número de partículas de um soluto iônico nesse tipo de solução.

Representação da ionização e dissociação de dois solutos diferentes
Ao multiplicar o número de partículas encontrado pela constante de Avogadro e pela massa molar, o fator de correção de Van't Hoff (representado por i) pode obter a real quantidade de partículas (íons) do soluto presente na solução.
A fórmula utilizada para a determinação do fator de correção de Van't Hoff é:
i = 1 + α.(q-1)
Na qual:
-
α = grau de ionização ou dissociação do soluto (sempre dado em porcentagem);
-
q = número de cátions e ânions presentes na fórmula da substância (por exemplo, na fórmula NaCl, temos um cátion e um ânion, logo q é igual a 2).
Exemplo: Qual é o número de partículas em uma solução preparada pela adição de 90 g de cloreto de cálcio em água?
1º Passo: Cálculo da massa molar do cloreto de cálcio (CaCl2), considerando que a massa atômica do Ca = 40 g/mol e a massa do Cl = 35,5 g/mol, e que a solução apresenta um grau de dissociação de 40%.
Massa molar = 1.40 + 2.35,5
Massa molar = 40 + 71
Massa molar = 111 g/mol
2º Passo: Montar a regra de três para determinar o número de partículas do soluto na solução.
Nessa regra de três, como foi dito anteriormente, na primeira linha, estão a massa molar e a constante de Avogadro e, na segunda linha, temos a incógnita e a massa do soluto que foi utilizado no preparo da solução.
1ª linha: 111 g-------------6,02.1023 partículas
2ª linha: 90 g------------- x
111.x = 90.6,02.1023
111x = 541,8.1023
x = 541,8.1023
111
x = 4,88.1023 partículas, aproximadamente
3º Passo: Cálculo do fator de correção de Van't Hoff.
Para isso, devemos levar em consideração que o grau de dissociação (α) do soluto é de 40%, e que, na fórmula da substância, temos a presença de 1 cátion (apenas um de Ca) e 2 ânions (2 de Cl), o que resulta em um q igual a 3. Assim:
i = 1 + α.(q-1)
i = 1 + 0,4.(3-1)
i = 1 + 0,4.(2)
i = 1 + 0,8
i = 1,8
4º Passo: Encontrar o número real (y) de partículas do soluto iônico presentes na solução.
Para isso, devemos apenas multiplicar o número de partículas do segundo passo pelo fator de correção encontrado no terceiro passo.
y = 4,88.1023.1,8
y = 8,784.1023 partículas