Bases são substâncias que, segundo Arrhenius, são capazes de aumentar a concentração de íons OH− (hidróxido) em solução. Embora existam teorias mais modernas sobre a descrição do comportamento básico (ou alcalino), as bases de Arrhenius são as mais conhecidas no mundo químico. Boa parte delas é feita por metais, com excessão do NH4OH, o qual só existe em solução aquosa.
Bases têm comportamento químico antagônico aos ácidos, sendo capazes de neutralizar sua ação parcial ou totalmente. As bases de Arrhenius são classificadas quanto à força, à solubilidade e ao número de ânions hidróxidos presentes. Dentre as principais bases, podemos citar NaOH, KOH, Ca(OH)2, Mg(OH)2 e Al(OH)3.
Leia também: Funções inorgânicas — as diferenças entre ácidos, bases, sais e óxidos
Tópicos deste artigo
- 1 - Resumo sobre as bases
- 2 - Videoaula sobre bases
- 3 - O que são bases?
- 4 - Principais características das bases
- 5 - Classificação das bases
- 6 - Como é a nomenclatura das bases?
- 7 - Principais bases e suas aplicações
- 8 - História das bases
- 9 - Exercícios resolvidos sobre bases
Resumo sobre as bases
- Segundo Arrhenius, bases são compostos que aumentam a concentração de íons hidróxido (OH−) em solução.
- A maioria das bases de Arrhenius é feita por metais, tendo caráter iônico.
- Bases apresentam comportamento químico antagônico aos ácidos.
- Podem ser classificadas quanto à solubilidade, à força e ao número de íons hidróxidos presentes.
- A nomenclatura oficial das bases é estabelecida pela Iupac, apresentando a estrutura básica “hidróxido de + nome do elemento”.
- Dentre as principais bases, podemos citar NaOH, KOH, Ca(OH)2, Mg(OH)2 e Al(OH)3.
Videoaula sobre bases
O que são bases?
Pensando em uma química mais atual, a definição de base está mais próxima de um comportamento químico desempenhado em uma reação do que de uma característica estrutural da substância.
De modo simples, podemos dizer que uma base é uma espécie química que, em solução, aumenta a concentração dos íons hidróxido (OH−). Essa ideia está em consonância com a teoria de Arrhenius. No entanto, na teoria de Brønsted-Lowry, uma base é uma espécie que tem um par de elétrons disponível capaz de formar uma ligação covalente com o um próton (H+).
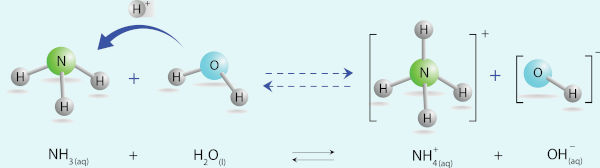
De forma mais ampla, Lewis determina que bases são espécies que, por terem um par de elétrons disponível, são capazes de se ligar covalentemente a uma espécie que tenha uma valência livre.
Visto que a teoria de Arrhenius foi a primeira forma de se identificar o comportamento de uma espécie básica, entende-se que as bases mais conhecidas têm a presença do ânion hidróxido (OH−) em sua estrutura.
Neste artigo, iremos nos atentar, então, aos hidróxidos (também chamados de bases de Arrhenius), embora, com base na teoria de Lewis, por exemplo, a presença de ânions hidróxido não se faz necessária para que uma substância seja considerada básica.
Principais características das bases
As bases de Arrhenius são quase sempre compostas por metais e, por isso, são majoritariamente de caráter iônico. A relativa força da ligação iônica permite que as bases sejam sólidas em temperatura ambiente. A única base de Arrhenius não metálica é o NH4OH. Contudo, essa base apenas existe em solução, fruto da hidratação da amônia, NH3.
NH3 + H2O ⇌ NH4OH
Embora seja esperado que compostos iônicos, por serem polarizados, sejam solúveis em água, isso não é tão linear quando se fala dos hidróxidos. É percebido que, quanto menor a carga do cátion e maior o seu raio, maior a sua solubilidade. Assim, o Mg(OH)2, cujo cátion é pequeno e a carga do metal é elevada, é uma base de pouca solubilidade em água; enquanto o CsOH, cujo cátion é grande e a carga do metal é menor, é uma base de alta solubilidade em água.
Resumidamente, é possível dizer que as bases de metais alcalinos são solúveis, enquanto as de metais alcalino-terrosos são menos solúveis, até mesmo pouco solúveis (no caso das bases de cálcio, magnésio e berílio). Já as bases dos demais metais são, de fato, muito pouco solúveis.
As bases têm caráter químico antagônico aos ácidos. Assim, promovem, com essa substância, uma reação conhecida como reação de neutralização. Nesse caso, há a formação de água, fruto da reação dos íons hidróxido com os íons H+ oriundos dos ácidos. O cátion da base e o ânion do ácido dão origem a um sal (se este for solúvel em água, faz-se necessária completa evaporação para sua obtenção):
ÁCIDO + BASE → SAL + H2O
Outra característica importante de uma base de Arrhenius é a sua força, que mensura o seu grau de dissociação. Na prática, indica se é uma substância que entrega uma solução com alta ou baixa concentração de íons hidróxido. Quanto maior a concentração final de OH−, maior a força da base.
Na Tabela Periódica, percebe-se que o caráter básico diminui da esquerda para a direita (dos metais alcalinos em direção aos ametais). Assim, as bases de metais alcalinos e alcalino-terrosos apresentam grande concentração final de íons hidróxido em solução. Algumas, inclusive, são ditas que realizam dissociação completa, ou seja, convertem-se completamente em íons hidróxido, como é o caso da base NaOH:
NaOH (s) → Na+ (aq) + OH− (aq)
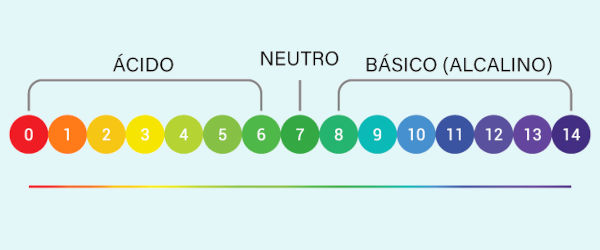
Existe uma escala muito importante para indicar a acidez ou alcalinidade da solução: é a escala pH. Essa escala varia de 0 a 14 e é medida de acordo com a concentração de íons H+ em solução (quanto maior a presença de íons H+, menor a escala pH). Soluções básicas fazem com que o valor de pH seja mantido entre 7 e 14.
Classificação das bases
As bases de Arrhenius podem ser classificadas da seguinte forma:
-
Classificação das bases quanto ao número de hidróxidos
- Monobases (apenas um OH−): NaOH, KOH, NH4OH...
- Dibases (apenas dois OH−): Mg(OH)2, Zn(OH)2, Sr(OH)2...
- Tribases (apenas três OH−): Al(OH)3, Au(OH)3...
- Tetrabases (apenas quatro OH−): Pb(OH)4...
-
Classificação das bases quanto à força (capacidade de dissociação)
Bases de metais alcalinos e de alguns metais alcalino-terrosos são consideradas fortes, ou seja, apresentam dissociação completa e se convertem completamente em íons OH− em solução.
Vale lembrar que elementos mais eletropositivos são considerados mais básicos. Contudo, para completa dissociação, faz-se necessário que a base esteja solubilizada (para que o OH− esteja presente em solução, obviamente). Assim sendo, bases de metais alcalino-terrosos pouco solúveis, como Mg(OH)2 e Be(OH)2, não são consideradas fortes.
-
Classificação das bases quanto à solubilidade
Como dito, bases solúveis combinam dois fatores: carga baixa e raio grande para o cátion. Assim, são consideradas solúveis as bases de metais alcalinos e NH4OH (que só existe em solução aquosa, aliás). Bases de metais alcalino-terrosos a partir do quarto período (Ca, Sr e Ba, por exemplo) apresentam certa solubilidade em água, mas, ainda assim, menor que de metais alcalinos.
|
Base de Arrhenius |
Solubilidade (g.L−1 de H2O, a 20 °C) |
|
NaOH |
1090 |
|
KOH |
1120 |
|
CsOH |
3857 |
|
Mg(OH)2 |
0,009 |
|
Ca(OH)2 |
1,65 |
|
Sr(OH)2 |
3,9 |
|
Ba(OH)2 |
38,9 |
|
Al(OH)3 |
0,008 |
Como é a nomenclatura das bases?
As regras das nomenclaturas das bases de Arrhenius são estabelecidas pela União Internacional de Química Pura e Aplicada (Iupac), no livro Nomenclature of Inorganic Chemistry – Iupac Recommendations, também conhecido como Red Book (Livro Vermelho).
O íon OH− é conhecido como hidróxido, e, segundo a Iupac, as bases de Arrhenius são montadas de acordo com o critério estequiométrico de nomenclatura. Assim sendo, o nome geral é dado por:
HIDRÓXIDO DE + NOME DO ELEMENTO
Contudo, alguns elementos que têm número de oxidação variável podem apresentar ambiguidade quanto à composição do hidróxido, visto que há mais de uma substância possível a ser formada.
Dessa forma, a Iupac aceita a utilização das cargas para fazer a distinção, sendo que esta deve ser indicada por algarismo romano dentro de um parêntesis e logo após o nome do elemento. Contudo, é comum a omissão dos parêntesis por parte de diversos autores. Assim, eis os nomes de algumas bases de Arrhenius:
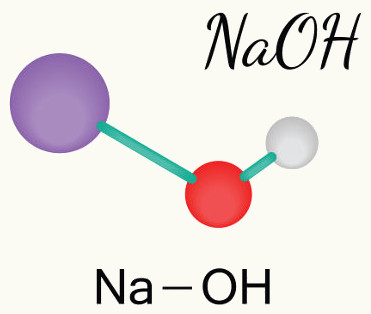
- NaOH: hidróxido de sódio
- KOH: hidróxido de potássio
- NH4OH: hidróxido de amônio
- Ca(OH)2: hidróxido de cálcio
- Mg(OH)2: hidróxido de magnésio
- Al(OH)3: hidróxido de aluminio
- Fe(OH)2: hidróxido de ferro (II) ou hidróxido de ferro II
- Fe(OH)3: hidróxido de ferro (III) ou hidróxido de ferro III
Um sistema antigo de nomenclatura, embora não mais tratado como oficial, deriva dos oxiácidos de Arrhenius, com a utilização dos sufixos -ICO (caso o elemento tenha maior número de oxidação) e -OSO (caso o elemento tenha o menor número de oxidação). Apesar de não ser oficial, esse sistema ainda é muito utilizado em alguns textos de Química:
- Fe(OH)2: hidróxido ferroso
- Fe(OH)3: hidróxido férrico
- CuOH: hidróxido cuproso
- Cu(OH)2: hidróxido cúprico
Principais bases e suas aplicações
- NaOH: O hidróxido de sódio é comercialmente vendido sob o nome de soda cáustica. Apresenta-se como um sólido branco, na forma de grânulos, flocos ou pastilhas. Tem uma característica marcante, que é o fato de ser muito higroscópico (absorve a umidade presente do ar). É uma base forte, de baixo custo, de alta solubilidade em água e em etanol. É usado na fabricação de papel, tecidos, sabão, detergente e até mesmo biodiesel. É um dos reagentes laboratoriais mais usados, sendo imprescindível a sua presença nos laboratórios. Para saber mais sobre ele, clique aqui.
- Mg(OH)2: O hidróxido de magnésio é muito conhecido na fabricação do antiácido comercialmente vendido sob o nome de leite de magnésia, aliviando a azia, a acidez estomacal e a má digestão. Também é empregado como laxante, sendo usado no tratamento de constipação ocasional.

- KOH: O hidróxido de potássio, assim como o de sódio, pode ser empregado na fabricação de sabões, detergentes e biocombustíveis. Contudo, como o potássio é um macronutriente das plantas, ele é empregado na fabricação de fertilizantes. Aproveitando-se sua alcalinidade, também é empregado na correção do pH dos solos. Na indústria, pode ser usado como agente sequestrante de CO2, SO3 e NO3 que possam vir a ser expelidos de chaminés. No refino do petróleo, ajuda na remoção de ácidos orgânicos e compostos sulfurados.
- Ca(OH)2: O hidróxido de cálcio, conhecido como cal hidratada, é formado durante processo de hidratação do óxido de cálcio na produção do concreto com base em argamassa. Assim, tem grande utilização na indústria de construção civil, sendo ingrediente básico para a produção de tijolos e cimento. Sua ação alcalina também pode ser empregada na correção do pH de solos atingidos por chuvas ácidas, auxiliando no crescimento das plantas. Em estações de tratamento de água, o hidróxido de cálcio pode ser usado para correção do pH, impedindo a corrosão dos canos de distribuição de água.
- Al(OH)3: O hidróxido de alumínio é também utilizado na indústria farmacêutica como antiácido para tratamento de azia, má digestão e acidez estomacal. No entanto, ele também é um conhecido retardante de chamas, pois, ao ser aquecido, libera vapores de água que auxiliam no resfriamento da área atingida pelas chamas. No tratamento de águas, pode atuar como coagulante, neutralizando cargas e, assim, permitindo a aglutinação das partículas de sujeira, tornando-as mais densas.
Leia também: Óxidos — função inorgânica que apresenta o oxigênio ligado a outro elemento
História das bases
Os compostos de caráter básico foram definidos adequadamente apenas com Svant Arrhenius, mas já vinham sendo usados desde tempos remotos da humanidade. Antes de serem chamadas de bases, os compostos químicos com tais características foram chamados de alcalinos, uma palavra que deriva do árabe, al-qali, que significa “cinzas calcinadas” de plantas salgadas, como a salicórnia.
Já o nome “base” começou a ser usado, em 1717, pelo químico francês Louis Lémery, como um sinônimo para o termo “matriz”, usado por Paracelsus. No entanto, uma utilização mais próxima da moderna do termo se deu com o químico francês Guillaume-François Rouelle, que fez menção à palavra “base” em um livro de memórias sobre sais escrito em 1754.
Nessa produção, Rouelle cita o grande aumento do número de sais descobertos nos séculos 17 e 18, não só pela preparação de sais novos como também pela maior habilidade em distinguir elementos de sódio e potássio, assim como uma revisão e generalização do conceito, que permitiu a entrada de novos compostos, como sulfatos, que anteriormente eram excluídos.
Assim, a fim de incoporar esse conceito mais extenso para formação de sais, Rouelle definiu sais neutros como o produto formado pela união de um ácido com qualquer substância, podendo ser ela um álcali solúvel em água, um álcali volátil, um óxido absorvente, um metal ou um óleo, capaz de servir como “base” para o sal, “dando-lhe uma forma sólida concreta”.
Exercícios resolvidos sobre bases
Questão 1
(Unifeso/2022-2) A soda cáustica é uma solução aquosa de NaOH e seu uso incorreto pode causar queimaduras no corpo e danos às vias respiratórias. O soluto da soda cáustica é nomeado:
- óxido de sódio
- nitrato de sódio
- cloreto de sódio
- hidróxido de sódio
Resposta: Letra D
O NaOH, comercialmente vendido sob o nome de soda cáustica, é nomeado como hidróxido de sódio, segundo a Iupac.
Questão 2
(Unisc Medicina Verão/2021) A hiperacidez gástrica pode ser precursora de alguns desconfortos como a pirose (sensação de ardência e queimação no esôfago). Em caso mais extremo, pode estar associada à úlcera gástrica.
Para combater esse problema, poderiamos empregar um antiácido à base de cátion trivalente, tendo como princípio ativo o
- hidróxido de sódio.
- ácido carbônico.
- hidróxido de alumínio.
- suco de limão.
- hidróxido de amônio.
Resposta: Letra C
O composto capaz de agir como um antiácido deve ter caráter básico. Contudo, o único composto de caráter básico que tem um cátion trivalente, ou seja, com carga +3, é o hidróxido de alumínio, de fórmula Al(OH)3.
Créditos da imagem
Fontes
USBERCO, J.; SALVADOR, E. Química. 9ª. ed. São Paulo: Saraiva, 2013.
JENSEN, W. B. The Origin of the Term “Base”. Journal of Chemical Education. v. 83, n. 8, ago. 2006.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. GoldBook – Compendium of Chemical Terminology. Disponível em: < https://goldbook.iupac.org/>.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Nomenclature of Inorganic Chemistry – IUPAC Recommendations. Cambridge, Inglaterra: RSC Publishing, 2005.
HOSPITAL SÍRIO-LIBANÊS. Hidróxido de Magnésio. 10 jun. 2016. Disponível em: <https://guiafarmaceutico.hsl.org.br/hidroxido-demagnesi>.
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO – CETESB. Hidróxido de Sódio. jul. 2020. Disponível em: < https://cetesb.sp.gov.br/laboratorios/wp-content/uploads/sites/24/2020/07/Hidro%CC%81xido-de-So%CC%81dio.pdf>.
BISLEY COMPANY. What is Aluminium Hydroxide used for? 1 jun. 2021. Disponível em: < https://bisley.biz/news/aluminium-hydroxide-uses/>.
AG CHEMI GROUP. Uses for KOH in Farming, the Chemical Industry, and Food Processing. 8 dez. 2021. Disponível em: < https://blog.agchemigroup.eu/uses-for-koh-in-farming-the-chemical-industry-and-food-processing/#:~:text=Potassium%20hydroxide%20is%20used%20to%20adjust%20and%20regulate%20the%20pH%20of%20soil.&text=KOH%20is%20used%20to%20produce,which%20cannot%20tolerate%20chloride%20ions.>.
STEWART, K. Calcium hydroxide. Britannica. Disponível em: < https://www.britannica.com/science/calcium-hydroxide>.
WASSERMAN, R. Ancient and Contemporany Industries Based on Alkali and Alkali-Earth Salts and Hydroxides: The Historical and Technological Review. Ionic Liquids – Thermophysical Properties and Applications. 2021.