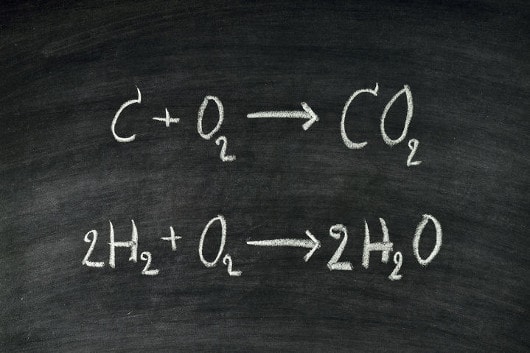Balancear uma equação química significa organizar os coeficientes (números que vêm antes das substâncias) a fim de que exista a mesma quantidade de átomos de cada elemento tanto no 1º membro (reagentes), quanto no 2º membro (produtos).
Existem várias formas de se fazer isso, mas, geralmente, o método de balanceamento mais usado em reações inorgânicas é o método das tentativas, por ser simples e eficiente.
Vamos tomar duas equações químicas como exemplos, para você visualizar como realizar esse método de balanceamento:
1º Exemplo:
Equação química: Zn(s) + HCl(aq ) → ZnCl2(aq )+ H2(g )
1º passo: escrever a quantidade de átomos de cada elemento, segundo mostrado nos respectivos índices:
Zn(s) + HCl(aq ) → ZnCl2(aq )+ H2(g )
Reagentes: Produtos:
Zn = 1 Zn = 1
H = 1 H = 2
Cl = 1 Cl = 2
Observe que essa equação não está balanceada, pois a quantidade de átomos de hidrogênio e de cloro não está igual.
2º passo: comece a “jogar” valores para os coeficientes das substâncias ou elementos, ou, ainda, radicais que aparecem apenas uma vez em ambos os membros e que possuam maior número de átomos com índices maiores.
Nesse caso, todos os elementos aparecem apenas uma vez no 1º e no 2º membro, assim vamos escolher a substância que apresenta maiores índices e números de átomos, que no caso é o ZnCl2. A ele vamos atribuir o coeficiente 1, que servirá de referência para os demais coeficientes. Desse modo, temos:
Zn(s) + HCl(aq ) → 1 ZnCl2(aq )+ H2(g )
Reagentes: Produtos:
Zn = Zn = 1
H = H =
Cl = Cl = 2
3º passo: prosseguir com os outros elementos usando o mesmo raciocínio.
Como já está especificado que no produto tem apenas um Zn e dois Cl, vamos transpor esses coeficientes para o primeiro membro:
1 Zn(s) + 2 HCl(aq ) → 1 ZnCl2(aq )+ H2(g )
Reagentes: Produtos:
Zn = 1 Zn =1
H = 2 H =
Cl = 2 Cl = 2
Observe que ao definir o coeficiente 2 para o Cl do primeiro membro, definimos também o coeficiente do H. Assim, no segundo membro deve haver também dois H. Visto que ele já apresenta índice igual a 2, o coeficiente deve ser 1:
1 Zn(s) + 2 HCl(aq ) → 1 ZnCl2(aq )+ 1 H2(g )
Reagentes: Produtos:
Zn = 1 Zn = 1
H = 2 H = 2
Cl = 2 Cl = 2
Agora sim a reação está balanceada, pois possui a mesma quantidade de átomos nos dois membros.
2º Exemplo:
Equação química: Al (OH)3 + H2SO4 → Al2 (SO4)3 + H2O
1º passo:
Al (OH)3 + H2SO4 → Al2 (SO4)3 + H2O
Reagentes: Produtos:
Al = 1 Al = 2
S = 1 S = 3
O = 7 O = 13
H = 5 H= 2
É necessário balanceá-la.
2º passo: não devemos “trabalhar” com o oxigênio nem com o hidrogênio, pois eles aparecem mais de uma vez nos dois membros, assim eles ficam para o final. Preferimos o Al (SO4)3, pois é o que apresenta mais átomos e maiores índices. A ele daremos o coeficiente igual a 1:
Al (OH)3 + H2SO4 → 1 Al2 (SO4)3 + H2O
Reagentes: Produtos:
Al = Al = 2
S = S = 3
O = O = 12+?
H = H =
3º passo: já está estabelecido que a quantidade de Al é 2 no segundo membro, assim esse também será o coeficiente da substância que possui esse elemento no primeiro membro (Al(OH)3). Também já está estabelecido que a quantidade de S é igual a 3, portanto, o coeficiente de H2SO4, será 3:
2Al (OH)3 + 3H2SO4 → 1 Al2(SO4)3 + H2O
Reagentes: Produtos:
Al = 2 Al = 2
S = 3 S = 3
O = 18 O = 12+?
H = 12 H =
Observe que falta apenas a água para ser balanceada. Visto que no primeiro membro temos 12 H, e no segundo o índice do H é igual a 2; o coeficiente que deveremos colocar, que multiplicado pelo índice dará 12, é 6:
2Al (OH)3 + 3H2SO4 → 1 Al2 (SO4)3 + 6H2O
Reagentes: Produtos:
Al = 2 Al = 2
S = 3 S = 3
O = 18 O = 18
H = 12 H = 12
Normalmente o último elemento que olhamos se está corretamente balanceado é o oxigênio. Nesse caso, deu certo e agora a equação está devidamente balanceada.
Observações importantes:
- A quantidade de cada elemento é dada multiplicando-se o coeficiente pelo índice; quando um dos dois não estiver escrito é porque é igual a 1;
O estado físico e a capacidade de formar íons são desconsiderados no balanceamento.