As aminas são compostos derivados da amônia (NH3). Para cada hidrogênio substituído por um grupo orgânico, temos um tipo de amina (primária, secundária e terciária). São compostos de caráter básico e exalam forte odor de peixe. Muitas das características químicas, como ponto de fusão, ebulição e densidade, variam conforme o tamanho e o tipo de cadeia carbônica ligada ao nitrogênio.
A nomenclatura desse grupo funcional é inconfundível, em razão da presença do termo “amina” como sufixo. As aminas estão presentes no nosso corpo como aminoácidos e são usadas na fabricação de corantes e fármacos.
Leia também: Nitrilos – substâncias orgânicas nitrogenadas derivadas do ácido cianídrico
Tópicos deste artigo
- 1 - Estrutura das aminas
- 2 - Classificação das aminas
- 3 - Propriedades das aminas
- 4 - Características das aminas
- 5 - Nomenclatura da aminas
- 6 - Reações das aminas
- 7 - Usos das aminas no cotidiano
- 8 - Exercícios resolvidos sobre amina
Estrutura das aminas
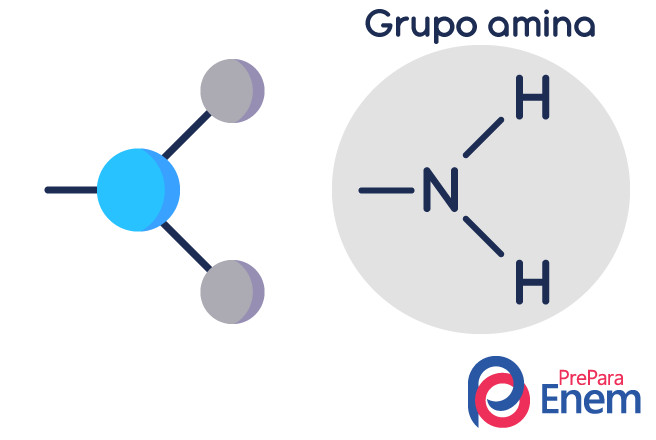
A molécula de amina tem uma estrutura em formato de pirâmide triangular — na Química, é chamada de geometria piramidal. O nitrogênio fica no “pico da pirâmide”, conectado por meio de ligações do tipo (sp³) aos radicais orgânicos, ou por ligação de hidrogênio aos hidrogênios não substituídos, que ficam nos vértices da base da pirâmide.
Classificação das aminas
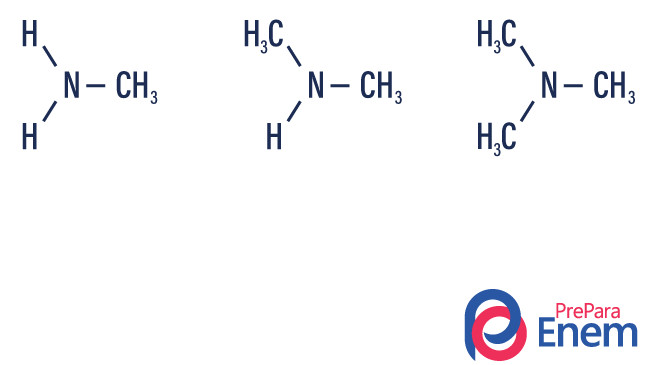
As aminas são derivadas da amônia (NH3). Assim, o que ocorre é a substituição dos hidrogênios da amônia por radicais, grupos de hidrocarbonetos (representados pela letra “R”). A classificação das aminas ocorre de acordo com o número de hidrogênios substituídos.
-
Amina primária → substituição de um hidrogênio por um radical orgânico (R-NH2).
-
Amina secundária → substituição de dois hidrogênios por dois radicais orgânicos (R1R2NH).
-
Amina terciária → substituição dos três hidrogênios ligados ao nitrogênio por radicais orgânicos (R1R2R3N).
Propriedades das aminas
-
Solubilidade: moléculas com até cinco carbonos são solúveis em água e álcool, e moléculas de amina com mais de cinco carbonos são insolúveis em água.
-
Densidade: aminas com radicais orgânicos de cadeia aberta têm densidade menor que 1 g/m³, e aminas que formam compostos aromáticos têm densidade maior que 1 g/m³.
-
Ponto de fusão e ebulição: alterados conforme o tamanho da cadeia carbônica dos substituintes. Quanto maior for a molécula, maior serão os pontos de fusão e ebulição.
-
Basicidade: aminas possuem caráter básico, em função do par de elétrons desemparelhado, fazendo com que a molécula doe esse par de elétrons e receba um íon H+. As aminas aromáticas tendem a ser bases mais fracas, pois o par de elétrons livres entra em ressonância com o anel aromático presente na molécula.
-
Toxidade: aminas aromáticas são compostos tóxicos e prejudiciais à saúde.
Veja também: Sal de amônio quaternário – composto nitrogenado com quatro radicais orgânicos no mesmo hidrogênio
Características das aminas
-
Estado físico: em condições normais de temperatura e pressão, aminas com 1 a 3 carbonos na molécula são gasosas; de 3 a 12 carbonos, são líquidas; e aminas com mais de 12 carbonos na molécula são sólidas.
-
Odor: aminas com pequenos radicais orgânicos, como metilamina e etilamina, possuem o odor característico da amônia, no entanto as demais aminas com substituintes maiores possuem odor forte de peixe.
-
Cor: são em sua maioria incolores.

Nomenclatura da aminas
A nomenclatura do grupo funcional amina, de acordo com a União Internacional da Química Pura e Aplicada (Iupac), será:
-
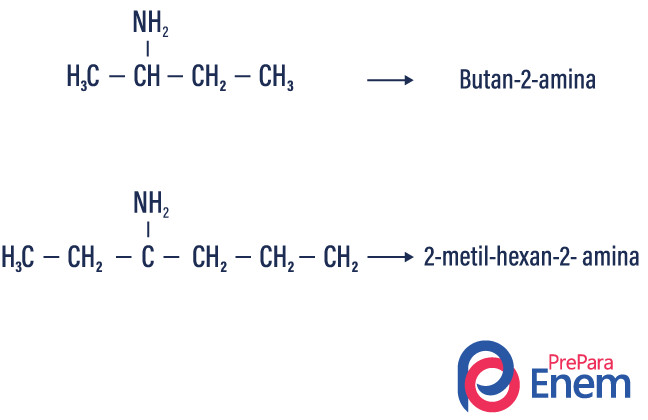
Nomenclatura de aminas primárias
|
Nome dos radicais substituintes + localização do carbono ligado diretamente ao nitrogênio + termo amina |
→ Nomenclatura para radical
Prefixo (indicando número de carbonos) + infixo (indicando tipo de ligação)
|
Prefixo |
Infixo |
|
1 carbono: met 6 carbonos: hex |
1 ligação simples: -an 1 ligação dupla: -en 1 ligação tripla: -ino 2 ligações duplas: -dieno |
→ Localização da amina: para localizar o carbono que se liga diretamente ao nitrogênio, é necessário fazer a contagem dos carbonos da cadeia, começando pelo lado mais próximo da amina. Se a localização for no carbono, não será necessário deixar explícito na nomenclatura.
Exemplos:
CH3-NH2 → Metanamina
CH3-CH2-NH2→ Etanamina
CH3-CH2-NH2 –> Etanamina
-
Nomenclatura das aminas secundárias e terciárias
N + radical menor (prefixo +il) + radical maior (com sufixo indicando tipo de ligação) + amina
A letra N que precede a nomenclatura faz referência ao nitrogênio ligado à cadeia carbônica, característico do grupo funcional amina.
Exemplos:
CH3-NH2-CH2-CH2 → N-metil-etanamina
CH3 – NH2-CH2-CH2-CH3 → N-etil-propanamina
Acesse também: Nomenclatura dos nitrocompostos – como fazer?
Reações das aminas
-
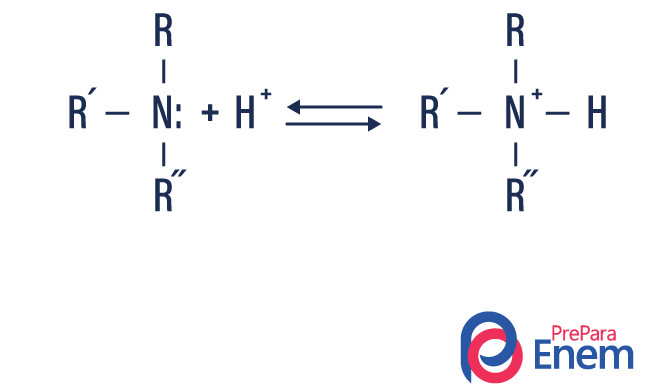
Reação ácido-base
A amina possui um par de elétrons desemparelhados, o que confere carácter básico à molécula. Na reação ácido-base, a amina recebe um íon H+, tornando-se uma molécula protonada.
-
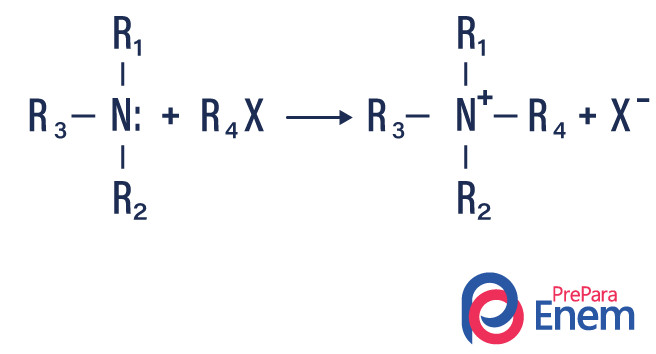
Alquilação de aminas
Nesse tipo de reação, o nitrogênio de uma amina primária ou secundária é transferido para um haleto ogânico, produzindo assim uma amina alqui-substituída e um ácido.
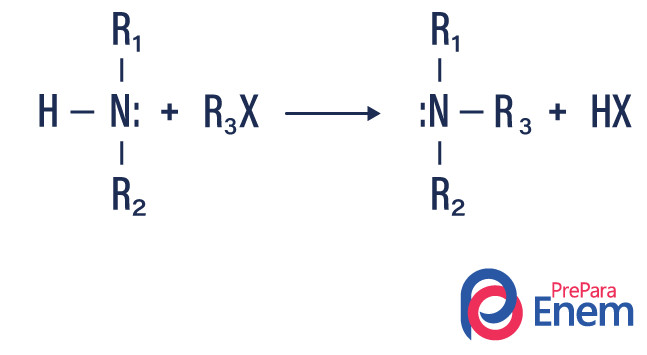
Caso a reação aconteça com uma amina terciária, o produto da reação será um amina quaternária protonada e um ânion de halogênio.
-
Acilação de aminas: acontece entre aminas primárias ou secundárias, podendo ser com cloretos de acila (RCOCl), formando uma amida e um ácido.
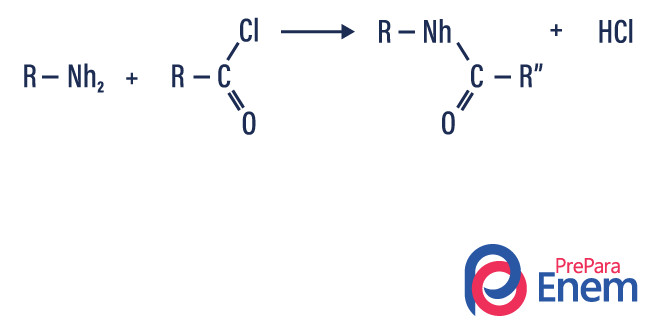
Também pode ocorrer com anidridos de ácido carboxílico (RCO)2O, formando uma amida e um ácido carboxílico.
-
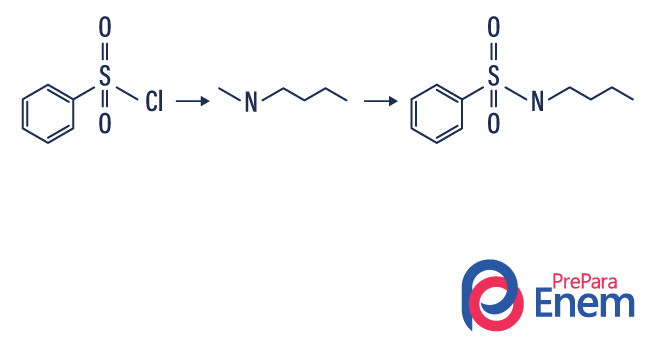
Reação de sulfonamida
A reação de sulfonamida é a reação que acontece nos testes de Hinsberg utilizados para detecção de aminas primárias e secundárias. Nesse caso, um cloreto de sulfonil (C6H4ClO2S) reage com a amida, formando uma sulfonamida.
Usos das aminas no cotidiano
-
As aminas estão presentes no nosso corpo. O grupo faz parte de alguns aminoácidos que participam da formação de proteínas e hormônios, como adrenalina e noradrenalina. Elas também são utilizadas na fabricação de remédios antidepressivos.
-
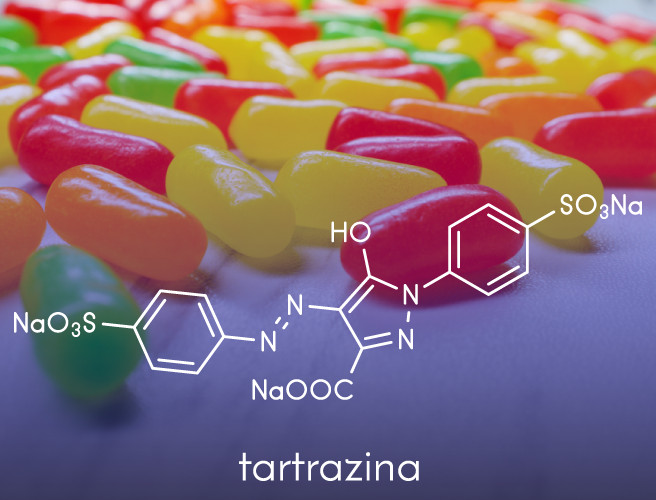
São utilizadas na fabricação de corantes artificiais aplicados em produtos alimentícios, como anilinas usadas em confeitarias.
-
Estão presentes na síntese de compostos orgânicos e na fabricação de sabão e cosméticos.
-
Fazem parte do processo de decomposição de matéria orgânica. O odor forte e desagradável que sentimos é proveniente das moléculas do grupo amina presentes no processo, como a cadaverina (C5H14N).
-
Aminas primárias são utilizadas em indústrias de mineralogia para beneficiamento ou apuramento dos metais. A amina é usada como agente de flotação, separando o que é mineral dos resíduos não desejados.
Leia também: TNT – explosivo usado para fins militares e para implosões
Exercícios resolvidos sobre amina
Questão 1 - (IFMT/2019 — adaptada) O amor ocorre à base de compostos químicos, você sabia? A atuação de neurotransmissores permite sensações tais como confiança, crença e prazer, deixando as pessoas apaixonadas. Por exemplo, a substância dopamina produz a sensação de felicidade; a adrenalina causa aceleração do coração e a excitação. Já a noradrenalina é responsável pelo desejo sexual entre um casal. Observando, a seguir, as fórmulas dessas substâncias, é possível considerar que:
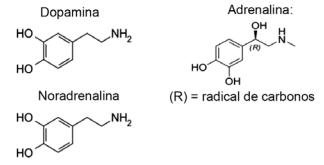
A) apenas a dopamina e a noradrenalina têm o grupo funcional das aminas.
B) a função álcool está presente apenas na noradrenalina.
C) todos os átomos de carbono da noradrenalina fazem entre si ligações duplas.
D) a adrenalina é a única que não apresenta cadeia carbônica heterogênea.
E) todas apresentam a função amina e álcool.
Resolução
Alternativa E. Todas as moléculas apresentadas pertencem à função amina, pois têm nitrogênio com substituintes orgânicos, e a função álcool, ou fenol, que é característico da hidroxila (OH) ligada ao hidrocarboneto, no caso dos hormônios ligados ao anel aromático.
Questão 2 - (FPS PE/2018) A aplicação de compostos nitrogenados em química orgânica sintética é muito diversificada e envolve a preparação de medicamentos, corantes, explosivos e vitaminas. Observe os compostos abaixo.
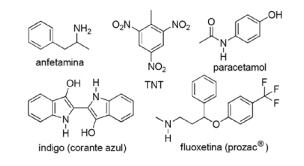
Sobre esses compostos, assinale a afirmativa incorreta.
A) O TNT é um nitrocomposto.
B) A porção nitrogenada da fluoxetina é uma amina secundária.
C) O TNT tem maior caráter básico que a anfetamina.
D) O índigo possui anéis heteroaromáticos em sua estrutura.
E) A porção nitrogenada do paracetamol é uma amida.
Resolução
Alternativa C. O TNT tera caráter MENOS básico que a fluoxetina, pois o grupo funciona amina do TNT está ligado diretamente ao anel aromático, diminuindo a disponibilidade do par de elétrons livres do nitrogênio, visto que eles entram em ressonância com o restante da molécula.