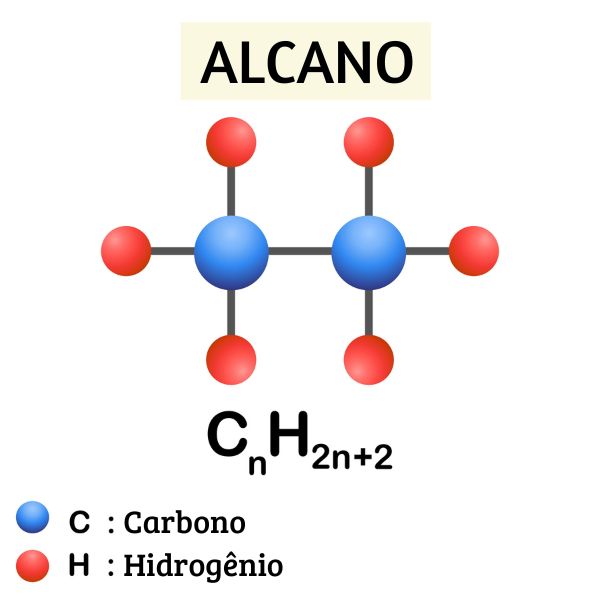
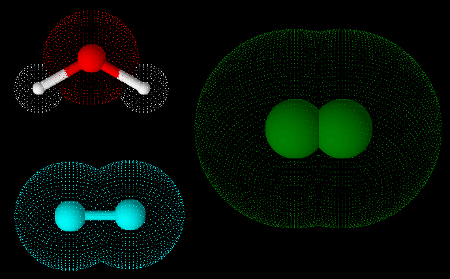
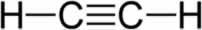Os alcanos são hidrocarbonetos que possuem apenas ligações simples entre os átomos de carbono, por isso são chamados de compostos saturados. Podem se apresentar em cadeias lineares, ramificadas e cíclicas, neste último caso, são conhecidos como cicloalcanos. Sua fórmula geral é: CnH2n+2.
De modo geral, os alcanos são pouco reativos, possuem caráter apolar, e suas propriedades de ponto de fusão e de ebulição variam de forma proporcional à extensão da cadeia carbônica. O petróleo e o gás natural são as principais fontes de obtenção dos alcanos, os quais possuem uma infinidade de aplicações, com destaque para os combustíveis.
Leia também: Aldeídos — os compostos que apresentam o grupo carbonila.
Tópicos deste artigo
- 1 - Resumo sobre alcanos
- 2 - O que são alcanos?
- 3 - Características e propriedades dos alcanos
- 4 - Fórmula dos alcanos
- 5 - Qual a nomenclatura dos alcanos?
- 6 - Isomeria dos alcanos
- 7 - Fontes de obtenção dos alcanos
- 8 - Para que serve os alcanos?
- 9 - Exercícios resolvidos sobre alcanos
Resumo sobre alcanos
-
São hidrocarbonetos, ou seja, formados apenas por átomos de carbono e hidrogênio.
-
São hidrocarbonetos saturados, isto é, possuem somente ligações simples entre os átomos de carbono. Sua fórmula geral é: CnH2n+2.
-
Suas cadeias podem ser lineares, ramificadas ou cíclicas.
-
São os hidrocarbonetos mais simples, possuem caráter apolar e são poucos reativos.
-
Quanto maior a extensão da cadeia carbônica, mais elevados serão o ponto de fusão e o ponto de ebulição.
-
Suas principais fontes de origem são o petróleo e o gás natural.
-
O gás natural é composto principalmente por metano (CH4).
-
O petróleo é uma complexa mistura de hidrocarbonetos, com grande teor de alcanos.
-
Pela destilação fracionada do petróleo, são isolados diferentes alcanos, de acordo com o tamanho da cadeia carbônica.
-
Com base no petróleo, obtém-se diversos produtos de uso comercial, inclusive combustíveis.
-
Além dos combustíveis, os alcanos encontram uma ampla gama de usos na indústria química.
O que são alcanos?
Os alcanos, também chamados de parafina, pertencem à classe dos hidrocarbonetos e são compostos saturados que possuem apenas ligações simples entre os átomos de carbono. Como são hidrocarbonetos, são inteiramente constituídos por átomos de carbono e hidrogênio, não possuindo outros grupos funcionais.
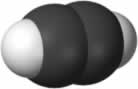
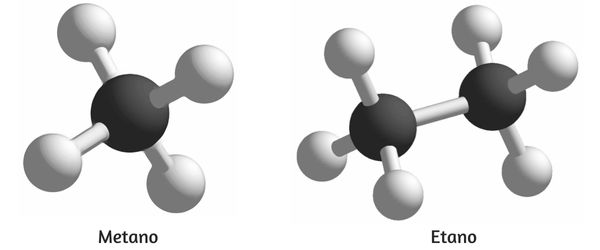
Os alcanos são as espécies de hidrocarbonetos mais simples. A imagem abaixo apresenta o alcano formado por um único átomo de carbono, nomeado metano, e o alcano constituído por dois átomos de carbono, denominado etano.
Os alcanos podem ser divididos em três grupos de acordo com a configuração da cadeia carbônica. Veja esses grupos a seguir.
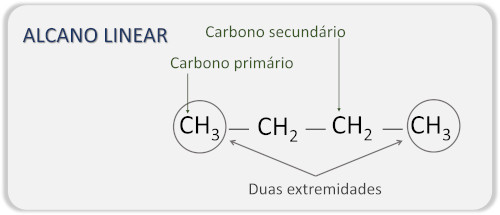
→ Alcanos de cadeia linear
Os alcanos de cadeia linear possuem como principal característica a ausência de ramificações e são formados apenas por carbonos primários (unidos a apenas um átomo de carbono) e secundários (unidos a outros dois átomos de carbono), ou seja, a cadeia possui apenas duas extremidades. Também são conhecidos como alcanos alifáticos ou acíclicos.
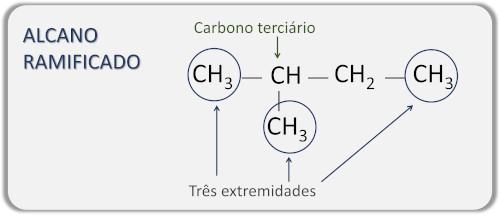
→ Alcanos de cadeia ramificada
Os alcanos de cadeia ramificada são moléculas que possuem mais de duas extremidades, possuindo, ao menos, um carbono terciário (unido a outros três átomos de carbono) ou quaternário (unido a outros quatro átomos de carbono), no qual se localiza a ramificação.
→ Alcanos de cadeia cíclica (cicloalcano)
Os cicloalcanos ou alcanos cíclicos se diferenciam dos demais pelo fato de que formam um anel de átomos de carbono, unidos entre si apenas por ligações simples. Essas estruturas também são chamadas de alcanos de cadeia fechada.
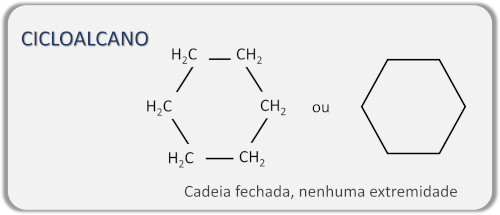
Veja também: Alcaloides — aminas que apresentam anéis heterocíclicos com o nitrogênio
Características e propriedades dos alcanos
Os alcanos são os hidrocarbonetos mais simples. Costumam ser incolores e inodoros, e são menos densos do que a água.
Uma característica que diferencia os alcanos dos demais hidrocarbonetos é a sua baixa reatividade, que se explica pela inexistência de insaturações, tornando as moléculas de alcanos estáveis quimicamente.
Nos alcanos, cada átomo de carbono estabelece quatro ligações simples, ou seja, são ligações sigma (σ). As ligações sigma são mais estáveis e mais fortes do que as ligações pi (π) em razão da maior interação que ocorre entre os orbitais atômicos de cada átomo durante o estabelecimento da ligação química.
Em Química orgânica, as ligações π presentes nas ligações duplas e triplas ― existentes nos alcenos e alcinos respectivamente ― tornam essas moléculas mais reativas em comparação aos alcanos. Isso não significa que os alcanos não sofrem nenhuma reação química. Na realidade, para que esse tipo de hidrocarboneto reaja, é necessário um aporte de energia extra por meio de calor ou de radiação.
A baixa reatividade dos alcanos proporciona aplicações interessantes em laboratório. Por exemplo, a possibilidade de atuar como solvente em diferentes reações químicas, garantindo a menor influência possível sobre o sistema em estudo.
Os alcanos possuem diversas outras aplicações, mas uma delas merece destaque: o seu uso como combustível. A gasolina, por exemplo, é uma mistura de alcanos com diferentes massas molares. A eficiência dos alcanos como combustíveis se deve à alta energia confinada nas ligações carbono-carbono e carbono-hidrogênio, a qual é prontamente liberada em uma reação de oxidação, como a combustão.
Os alcanos são substâncias não polares (ou apolares) e, por isso, são imiscíveis em solventes polares, como a água. Por outro lado, são totalmente miscíveis em outras substâncias de caráter apolar, como o benzeno ou tolueno.
Quando há um derramamento de petróleo no mar, essa substância não se mistura à água, em razão das diferentes polaridades. O petróleo é formado por uma mistura de alcanos, possuindo caráter apolar e, por isso, não é capaz de se misturar à água, uma substância polar.

Os alcanos formados por até quatro átomos de carbono são substâncias gasosas e de alta inflamabilidade. São exemplos disso o metano, o etano, o propano e o butano.
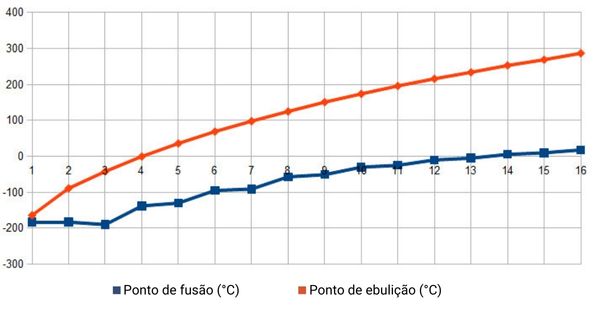
A partir do pentano até o octadecano ― hidrocarboneto com cinco e 18 carbonos respectivamente ―, os alcanos são líquidos. O pentano possui temperatura de ebulição relativamente baixa, em torno de 36 °C. Os alcanos mais longos têm seus pontos de fusão aumentados gradativamente, em razão da elevação da massa molecular.
Cadeias carbônicas com mais de 18 carbonos tendem a formar substâncias cerosas e mais densas. As ceras das velas, por exemplo, são formadas por cadeias com 20 a 25 átomos de carbonos.
O gráfico abaixo mostra a tendência de elevação das temperaturas de fusão (em azul) e de ebulição (em vermelho), de acordo com o maior tamanho das cadeias carbônicas, para uma sequência de alcanos de até 16 carbonos. Apesar de não ser mostrado no gráfico, a tendência se mantém para cadeias mais longas.
Fórmula dos alcanos
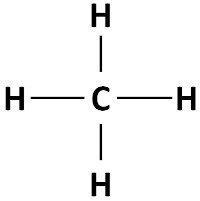
A fórmula geral para os alcanos é CnH2n+2, sendo n o número de carbonos. Considerando isso, o alcano mais simples que pode existir é o metano, que possui um único átomo de carbono e, portanto, quatro átomos de hidrogênio.
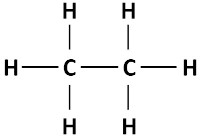
Pela fórmula geral para os alcanos, é possível prever a quantidade de hidrogênios existentes na molécula com base no número de carbonos. Por exemplo, quando n = 2, o número de hidrogênios é 6 e a fórmula molecular do alcano é C2H6.
Quando n = 3, o número de hidrogênios é 8 e a fórmula molecular do alcano é C3H8.
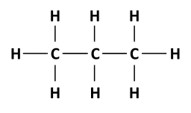
Quando n = 8, o número de hidrogênios é 18 e a fórmula molecular do alcano é C8H18.
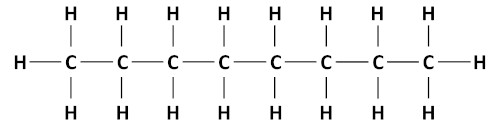
Importante: Quando se tratar de alcanos cíclicos (cicloalcanos), a fórmula geral passa a ser CnH2n.
Qual a nomenclatura dos alcanos?
A nomenclatura dos alcanos deve seguir as regras definidas pela Iupac (International Union of Pure and Applied Chemistry) para a nomenclatura dos hidrocarbonetos.
O nome da molécula se inicia pelo prefixo, que corresponde ao número de carbonos da cadeia principal. Em seguida, há o infixo, indicando a presença ou não de insaturações. Para os alcanos, moléculas saturadas, o infixo será -an-, terminado pelo sufixo -o, indicando que se trata de um hidrocarboneto.

A tabela apresentada na sequência traz os prefixos que devem ser utilizados a depender do número de carbonos da cadeia principal da molécula de hidrocarboneto.
|
Número de carbonos |
Prefixo |
|
1 |
Met- |
|
2 |
Et- |
|
3 |
Prop- |
|
4 |
But- |
|
5 |
Pent- |
|
6 |
Hex- |
|
7 |
Hept- |
|
8 |
Oct- |
|
9 |
Non- |
|
10 |
Dec- |
Vejamos alguns exemplos:
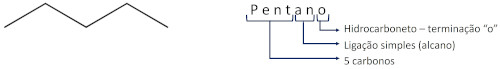
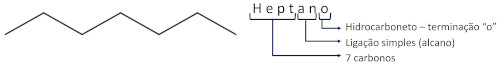
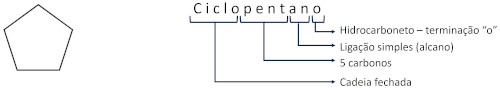
Nos alcanos ramificados, a localização da ramificação deve ser identificada de acordo com a numeração do carbono da cadeia principal no qual ela se localiza. A identificação da ramificação vem antes do nome do alcano.
Veja:
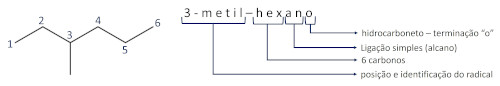
Saiba mais: Nomenclatura dos alcadienos — como é estabelecida?
Isomeria dos alcanos
Isômeros são moléculas que possuem a mesma fórmula molecular, mas apresentam um arranjo diferente de átomos no espaço, excluídos quaisquer arranjos que sejam simplesmente em razão de rotação da molécula em torno de uma ligação.
No isomerismo estrutural, os átomos estão dispostos em ordens diferentes, e, dentro desse tipo de isomeria, há diversos tipos. Para os alcanos, a isomeria em cadeia é a mais relevante e ocorre em razão da possibilidade de existência das ramificações na cadeia carbônica.
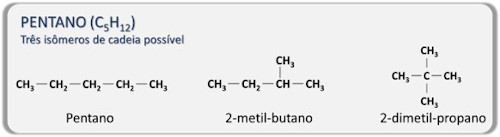
A quantidade de isômeros possíveis para um alcano aumenta de acordo com o número de átomos da cadeia carbônica. Veja:
|
Nome |
Fórmula molecular |
Quantidade de isômeros possíveis |
|
Metano |
CH4 |
1 |
|
Etano |
C2H6 |
2 |
|
Propano |
C3H8 |
1 |
|
Butano |
C4H10 |
2 |
|
Pentano |
C5H12 |
3 |
|
Hexano |
C6H14 |
5 |
|
Heptano |
C7H16 |
9 |
|
Octano |
C8H18 |
18 |
|
Nonano |
C9H20 |
35 |
|
Decano |
C10H22 |
75 |
Fontes de obtenção dos alcanos
Os alcanos são obtidos de duas principais fontes: o petróleo e gás natural. Ambos ocorrem em formações geológicas específicas.
O petróleo é uma mistura complexa de hidrocarbonetos, contendo elevada fração de alcanos. O gás natural é uma mistura de hidrocarbonetos de cadeia curta, contendo em maior quantidade metano e etano e, em menor proporção, propano e butano.
O petróleo e o gás natural ficam contidos em rochas porosas que estão sob formações rochosas impermeáveis. Essas substâncias têm origem na matéria orgânica derivada de restos de animais e plantas que se acumularam no fundo de mares antigos e foram sendo recobertos por camadas de sedimentos. Em razão do ambiente com baixa oxigenação, alta temperatura e alta pressão, a matéria orgânica foi lentamente convertida à sua forma atual, ao longo de milhões de anos.
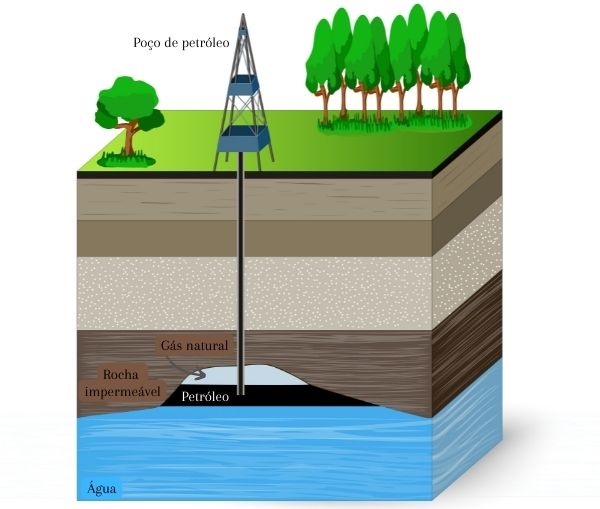
O gás natural e o petróleo são utilizados como fonte de energia para veículos e máquinas. Em razão do processo lento de formação, esses dois combustíveis são considerados fontes não renováveis de energia, uma vez que não podem ser novamente preparados em um curto intervalo de tempo.
O metano (CH4) ― hidrocarboneto mais simples existente ― é encontrado no biogás, o gás gerado por animais e pela degradação da matéria orgânica. O metano também é conhecido como gás de lixão ou gás de pântano, pois é naturalmente produzido nesses locais em razão dos processos de decomposição de matéria orgânica. O metano obtido dessas fontes é considerado uma fonte renovável de energia.
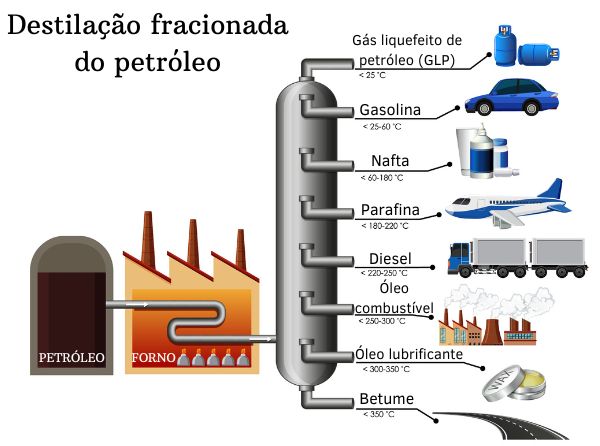
O gás natural é prontamente obtido dos bolsões encontrados nas rochas porosas, por meio de sua drenagem por um sistema de encanamento. Após a mistura de hidrocarbonetos que forma o petróleo, os alcanos são isolados por meio da destilação fracionada, um processo físico de separação executado em equipamentos específicos em refinarias.
Processos químicos como a reforma catalítica e o craqueamento também são empregados para a obtenção de alcanos das frações de elevada massa molecular, separadas do petróleo por meio da destilação fracionada.
Para que serve os alcanos?
Os alcanos são o principal constituinte da maioria dos combustíveis e de óleos lubrificantes, sendo extensivamente utilizados na indústria química.
O metano e etano ― constituintes principais do gás natural ― são empregados em sistemas de aquecimento e de cozimento. O gás natural também é usado como combustível e é conhecido como gás natural veicular (GNV).
Por meio da destilação fracionada do petróleo, são obtidas diferentes frações de hidrocarbonetos, separados em função dos distintos pontos de ebulição, propriedade que reflete os diferentes tamanhos da cadeia carbônica. Quanto mais elevado o ponto de ebulição, maior a quantidade de carbonos que compõem a cadeia.
A tabela abaixo reúne informações sobre a extensão dos alcanos, suas propriedades e principais aplicações.
|
Extensão da cadeia carbônica |
Propriedades e aplicações principais |
|
3 a 4 carbonos |
Propano e butano são liquefeitos a baixas pressões e, por isso, são utilizados como propulsores em aerossóis, queimados de gás e isqueiros. |
|
5 a 8 carbonos |
Alcanos em estado líquido e altamente voláteis. São empregados como solventes apolares e como combustíveis em motores de combustão. O octano (C8H18) é um dos principais constituintes da gasolina. |
|
9 a 16 carbonos |
Alcanos líquidos de maior viscosidade empregados como óleo diesel e querosene (combustível de avião). |
|
17 a 35 carbonos |
Alcanos líquidos de alta viscosidade ou sólidos. São utilizados na composição de óleos lubrificantes e como agentes anticorrosão (em razão da natureza hidrofóbica). Os alcanos sólidos são empregados como cera ou parafina (velas). |
|
Mais de 35 carbonos |
Alcanos utilizados para a pavimentação de estradas (asfalto). Possuem pouca aplicação industrial, por isso, geralmente são submetidos aos processos de craqueamento, sendo transformados em alcanos de menor massa molar. |
Exercícios resolvidos sobre alcanos
Questão 1
(Uerj) Os vários componentes do petróleo são separados por um processo denominado destilação fracionada. Em sua destilação, alguns hidrocarbonetos são separados na ordem indicada no esquema abaixo:
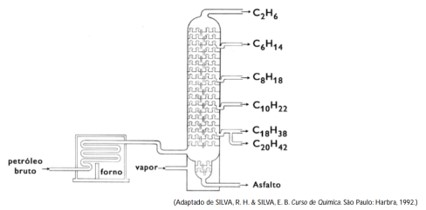
A ordem de destilação desses componentes do petróleo está justificada pela seguinte afirmação:
A) os alcanos são os hidrocarbonetos mais voláteis.
B) os hidrocarbonetos são líquidos de baixo ponto de ebulição.
C) o aumento da massa molar dos hidrocarbonetos provoca maior volatilidade.
D) o ponto de ebulição dos hidrocarbonetos aumenta com o aumento da massa molar.
Resolução:
Alternativa D
O item A está incorreto, pois todas as frações resultantes da destilação fracionada do petróleo são hidrocarbonetos. A depender da extensão da cadeia carbônica, essas frações serão sólidas, líquidas ou gasosas. Aqueles hidrocarbonetos de baixa massa molar possuem maior tendência à volatilidade.
O item B está incorreto. Como descrito acima, os hidrocarbonetos são sólidos, líquidos ou gasosos, a depender da extensão da cadeia carbônica. O ponto de ebulição dos hidrocarbonetos depende do tamanho da cadeia.
O item C está incorreto. O aumento da massa molar dos hidrocarbonetos provoca uma diminuição da volatilidade e elevação dos pontos de ebulição, o que está de acordo com a alternativa D.
Questão 2
(Instituto AOCP/UFPB) Sobre hidrocarbonetos, informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
( ) Hidrocarbonetos são substâncias orgânicas constituídas somente por átomos de carbono e hidrogênio.
( ) São chamados de alcanos os hidrocarbonetos insaturados de cadeia ramificada.
( ) O benzeno é um hidrocarboneto de cadeia aberta e possui três instaurações.
( ) O propano é um hidrocarboneto insaturado de cadeia aberta.
( ) Os alcinos possuem, obrigatoriamente, uma ligação tripla entre carbonos.
A) F – V – V – V – F.
B) V – F – V – V – F.
C) V – F – F – F – V.
D) F – F – V – F – V.
E) F – F – F – V – V.
Resolução:
Alternativa C
Hidrocarbonetos são substâncias orgânicas constituídas somente por átomos de carbono e hidrogênio. (Verdadeiro)
São chamados de alcanos os hidrocarbonetos insaturados de cadeia ramificada. (Falso)
Os hidrocarbonetos têm como característica conter apenas ligações simples entre átomos de carbono, ou seja, são compostos saturados.
O benzeno é um hidrocarboneto de cadeia aberta e possui três instaurações. (Falso)
O benzeno é um hidrocarboneto de cadeia cíclica e possui três instaurações.
O propano é um hidrocarboneto insaturado de cadeia aberta. (Falso)
O propano é um alcano, logo, possui cadeia saturada.
Os alcinos possuem, obrigatoriamente, uma ligação tripla entre carbonos. (Verdadeiro)
Crédito de imagem
[1] Wikimedia Commons (reprodução)