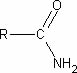
A acrilamida é uma molécula orgânica que pertence ao grupo funcional das amidas. Estas apresentam como característica estrutural básica o seguinte grupo:

Grupo funcional da amidas
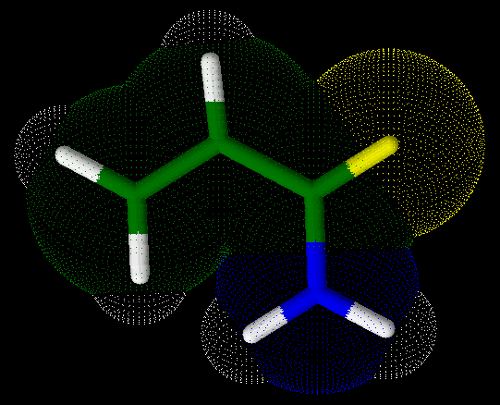
A acrilamida, também chamada de Pop-2-enamida (segundo a regra de nomenclatura estabelecida pela IUPAC para as amidas), apresenta em sua estrutura três átomos de carbono e uma ligação pi entre dois deles, como podemos observar a seguir:

Fórmula estrutural da acrilamida
As principais características físicas e químicas da acrilamida são:
-
Substância polar;
-
Baixa massa molar – Com a fórmula molecular da acrilamida (C3H5ON) e o valor da massa atômica de cada elemento (H = 1 g/mol; N = 14 g/mol; O = 16 g/mol; C = 12 g/mol), calculamos sua massa molar multiplicando a quantidade de átomos pela massa do elemento:
H = 5.1 =5 g/mol
N = 1.14 = 14 g/mol
O = 1.16 = 16 g/mol
C = 3.12 = 36 g/mol
Massa molar = 5 + 14 + 16 + 36
Massa molar = 71 g/mol
-
Baixo ponto de fusão (84,5oC), o que é influenciado pela baixa massa molar da substância;
-
Insolúvel em hidrocarbonetos, como o benzeno;
-
Solúvel em solventes polares, como a água, metanol, etanol e acetona;
-
Em temperatura ambiente, apresenta-se como um sólido branco cristalino;
-
Elevada reatividade com o ar;
-
Capaz de sofrer polimerização por adição.
A acrilamida é uma substância bastante consumida pelo ser humano, principalmente na ingestão dos seguintes alimentos:
-
Salgadinhos à base de milho;
-
Mandioca frita;
-
Batata fita;
-
Pães;

Os pães são uma grande fonte de consumo de acrilamida
-
Farinhas;
-
Café;
-
Cerveja;
-
Cereais matinais;
-
Biscoitos;
-
Pipoca.
Vale ressaltar que a acrilamida não é adicionada aos alimentos, mas, sim, formada. Estudos científicos descobriram que a acrilamida é produzida, por exemplo, a partir da reação química entre a substância asparagina (enzima) e a glicose (carboidrato), ou seja, a acrilamida é originada quando alimentos ricos em carboidratos são submetidos a um aquecimento igual ou superior a 120 oC na presença de enzimas.

Fórmula estrutural da glicose
.jpg)
Fórmula estrutural da asparagina
Alguns estudos científicos descobriram que a acrilamida pode ser tóxica para o ser humano. Segundo esses estudos, ela pode provocar distúrbios neurotóxicos e desenvolvimento de câncer.
Além da alimentação, entramos em contato com a acrilamida também quando respiramos a fumaça produzida na queima do cigarro. Todavia, vale ressaltar que não existe ainda nenhum dado conclusivo sobre a quantidade de acrilamida capaz de promover malefícios ao ser humano.
Abolir a ingestão dos vários dos alimentos mencionados é praticamente impossível, por isso, vários estudos científicos estão sendo realizados para averiguar qual é o nível tolerável de ingestão dessa substância ou mesmo como evitar que ela seja originada nos alimentos quando aquecidos. Até que esse conhecimento seja atingido, o recomendável é consumir em menor quantidade alimentos que originem a acrilamida.
A acrilamida começou a ser produzida de forma industrial em 1950 por meio da hidratação da acrilonitrila (molécula que apresenta uma ligação pi entre dois carbonos e duas ligações pi entre um carbono e o nitrogênio).

Fórmula estrutural da acrilonitrila
Durante a hidratação da acrilonitrila, ocorre a quebra das duas ligações pi entre o carbono e o nitrogênio. Assim, as duas ligações do nitrogênio são preenchidas com os dois hidrogênios da molécula de água, e as duas ligações do carbono são realizadas com o oxigênio da molécula de água.

Reação de hidratação da acrilonitrila
A substância acrilamida foi muito utilizada na construção de túneis e barragens. Todavia, ela apresenta mais aplicações na forma polimerizada, ou seja, na forma de poliacrilamida. A formação da poliacrilamida ocorre pela união de moléculas de acrilamida após a quebra da ligação pi entre os carbonos 2 e 3 da sua cadeia.

Reação de polimerização da acrilamida
Os principais usos da poliacrilamida são:
-
Cromatografia
-
Eletroforese em laboratório
-
Indústrias de produção de papel
-
Tratamento de águas residuais e esgoto
-
Produção de cosméticos
-
Produção de artigos de higiene