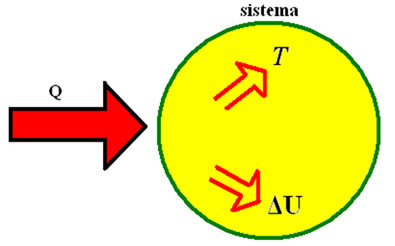
A segunda lei da termodinâmica é uma das leis mais importantes da Física, já que introduz a entropia como um fenômeno natural e não reversível e as restrições para a construção de máquinas térmicas e refrigeradores.
Leia também: O que é equilíbrio térmico?
Tópicos deste artigo
- 1 - Resumo sobre segunda lei da termodinâmica
- 2 - O que é a segunda lei da termodinâmica?
- 3 - Qual é a segunda lei da termodinâmica?
- 4 - Quais são as aplicações da segunda lei da termodinâmica?
- 5 - Fórmulas da segunda lei da termodinâmica
- 6 - Entropia e a segunda lei da termodinâmica
- 7 - Ciclo de Carnot
- 8 - Quais são as leis da termodinâmica?
- 9 - Exercícios sobre a segunda lei da termodinâmica
Resumo sobre segunda lei da termodinâmica
- A segunda lei da termodinâmica é aquela que diz que é impossível construir uma máquina que transforme todo o calor em trabalho.
- É empregada no funcionamento das máquinas térmicas e refrigeradores.
- A variação de entropia é dada pela variação de energia interna de um sistema pela sua temperatura.
- O ciclo de Carnot é ideal, não real, já que as máquinas não são capazes de atingir 100% de rendimento, considerando que, assim, violariam a segunda lei da termodinâmica.
- A lei zero, a primeira lei, a segunda lei e a terceira lei da termodinâmica compõem as leis da termodinâmica.
O que é a segunda lei da termodinâmica?
A segunda lei da termodinâmica é a que estabelece que o fluxo de calor do corpo de temperatura baixa para um de temperatura alta só ocorre mediante a execução de trabalho sobre o sistema termodinâmico; e que é impossível a fabricação de uma máquina térmica ou refrigerador com 100% de eficiência, ou seja, sem dissipação de calor. Foi enunciada pelos cientistas Rudolf Clausius (1822-1888), William Thomson (conhecido como Lorde Kelvin, 1824-1907) e Max Planck (1858-1947),
Qual é a segunda lei da termodinâmica?
A segunda lei da termodinâmica pode ser enunciada como:
“Não existe uma série de processos cujo único resultado seja a transferência de energia, na forma de calor, de uma fonte em certa temperatura para uma fonte em uma temperatura mais elevada, sem a necessidade de realizar trabalho.”
Esse enunciado significa que nenhuma máquina térmica é capaz de transferir totalmente a sua energia, em forma de calor, entre fontes em temperaturas diferentes, sem que realize trabalho, dessa forma, não existem máquinas térmicas perfeitas.
Veja também: Como ocorre o processo de condução térmica?
Quais são as aplicações da segunda lei da termodinâmica?
As aplicações da segunda lei da termodinâmica são as máquinas térmicas e os refrigeradores.
-
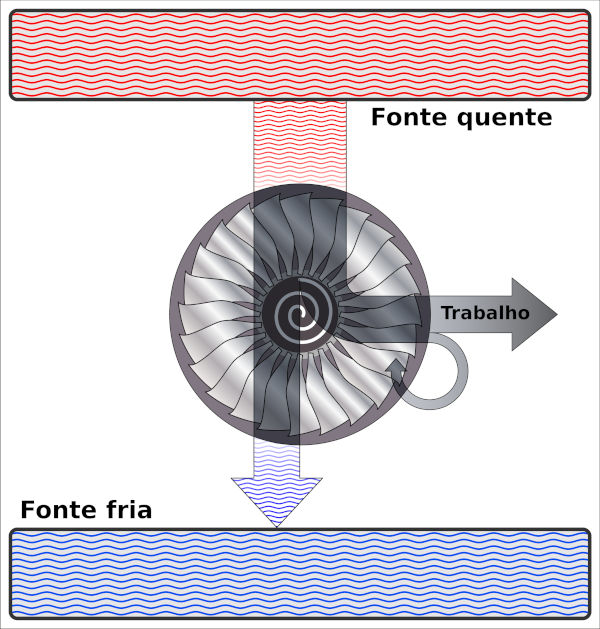
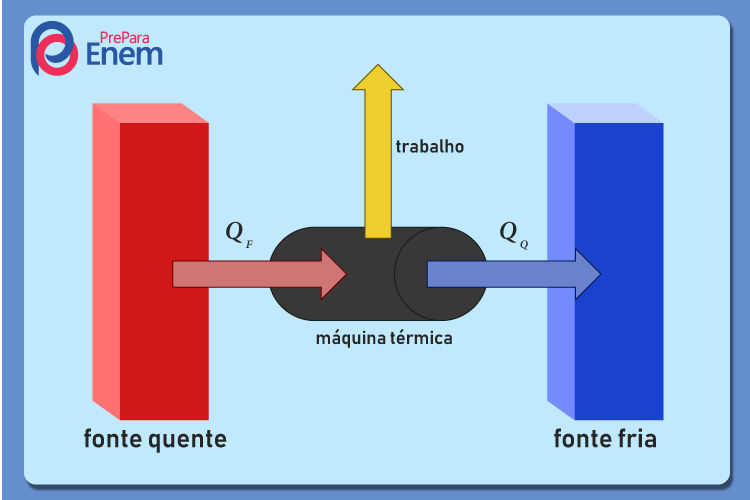
Segunda lei da termodinâmica em máquinas térmicas
As máquinas térmicas são aquelas que transformam parte do calor recebido de uma fonte quente em trabalho e que dissipam o restante desse calor transferindo-o a uma fonte fria, conforme demonstrado na imagem abaixo:
Existem diversos tipos de máquinas térmicas, como os reatores termonucleares e os motores que funcionam a combustão.
-
Segunda lei da termodinâmica em refrigeradores
Os refrigeradores são aqueles que retiram o calor de uma fonte fria e o transferem a uma fonte quente via execução de trabalho sobre a máquina, de modo inverso ao das máquinas térmicas, conforme demonstrado na imagem abaixo:
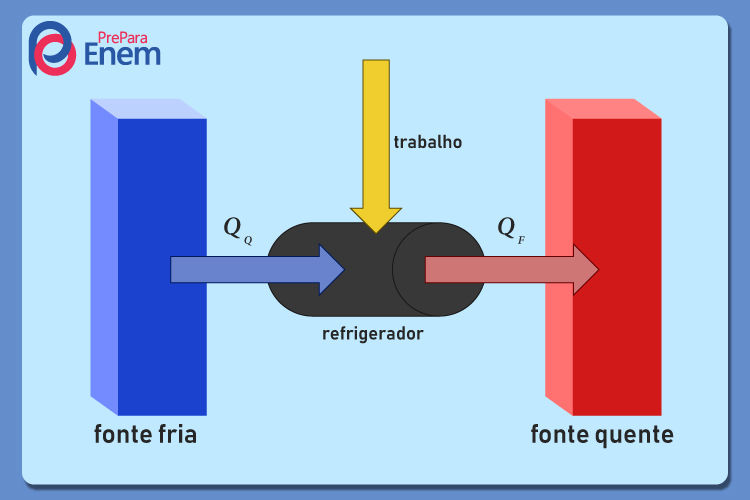
Existem diversos tipos de refrigeradores, como os ares-condicionados e as geladeiras.
Fórmulas da segunda lei da termodinâmica
-
Máquinas térmicas e refrigeradores
\(Q_Q = W + Q_F \)
QQ é o calor da fonte quente, medido em Joule [J].
W é o trabalho realizado pela máquina térmica, medido em Joule [J].
QF é o calor da fonte fria, medido em Joule [J].
Pode ser representada por:
\(W = Q_Q - Q_F \)
W é o trabalho realizado pela máquina térmica, medido em Joule [J].
QQ é o calor da fonte quente, medido em Joule [J].
QF é o calor da fonte fria, medido em Joule [J].
-
Refrigeradores
\(\eta = \frac{Q_F}{Q_Q - Q_F} \)
η é o rendimento do refrigerador.
QF é o calor da fonte fria, medido em Joule [J].
QQ é o calor da fonte quente, medido em Joule [J].
Pode ser representada assim:
\(\eta = \frac{Q_F}{W} \)
η é o rendimento do refrigerador.
QF é o calor da fonte fria, medido em Joule [J].
W é o trabalho realizado pela máquina térmica, medido em Joule [J].
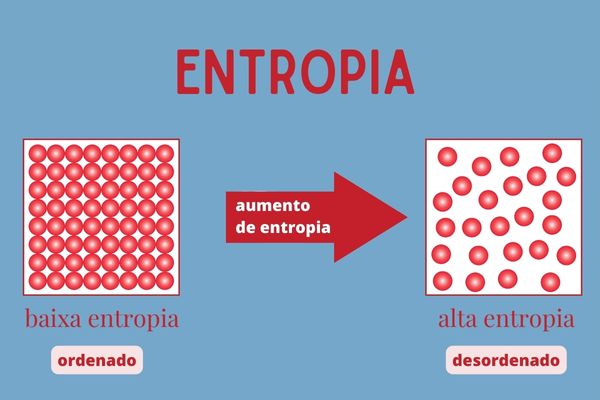
Entropia e a segunda lei da termodinâmica
A entropia é uma grandeza termodinâmica proposta pela segunda lei da termodinâmica. De modo geral, indica o grau de desorganização ou aleatoriedade de um sistema termodinâmico, assim, a sua entropia aumenta à medida que o grau de desorganização do sistema também aumenta.
Ela também é um fenômeno espontâneo, inevitável, não reversível e expansivo. Isso significa que a desorganização do sistema acontece naturalmente, sem possibilidade de ser revertida, e aumenta constantemente. Podemos calcular a entropia pela fórmula:
\(\Delta S = \frac{\Delta U}{T} \)
∆S é a variação de entropia, medida em [J/K].
∆U é a variação de energia interna, medida em Joule [J].
T é a temperatura, medida em Kelvin [K].
Já do ponto de vista estatístico, podemos calcular a entropia pela fórmula:
\(S = k \cdot \ln \Omega \)
S é a entropia, medida em [J/K].
k é a constante de Boltzmann, vale \(1,4 \cdot 10^{-23} J⁄K\).
Ω é número de microestados possíveis para o sistema.
Ciclo de Carnot
O ciclo de Carnot é o ciclo termodinâmico ideal, formulado pelo cientista Sadi Carnot (1796-1832), que descreve uma série de transformações termodinâmicas para identificar o máximo de rendimento que uma máquina térmica pode ter quando operada entre uma fonte quente e uma fonte fria. Para isso, Carnot considerou que esse ciclo fosse reversível, ou seja, pode ser invertido, surgindo, assim, os refrigeradores.
Levando em consideração a proporcionalidade entre a quantidade de calor e a temperatura das fontes, pode se obter as equações de rendimento de uma máquina de Carnot (máquina que funciona pelo ciclo de Carnot):
\(\eta = 1 - \frac{T_F}{T_Q} \)
η é o rendimento da máquina térmica.
TF é a temperatura da fonte fria, medida em Kelvin [K].
TQ é a temperatura da fonte quente, medida em Kelvin [K].
Também pode ser representada assim:
\(\eta = 1 - \frac{|Q_F|}{|Q_Q|} \)
η é o rendimento da máquina térmica.
|QF| é o módulo do calor da fonte fria, medido em Joules [J].
|QQ| é o módulo do calor da fonte quente, medido em Joules [J].
O trabalho no ciclo de Carnot é dado por:
W≅ área do gráfico
W é o trabalho do gás, medido em Joules [J].
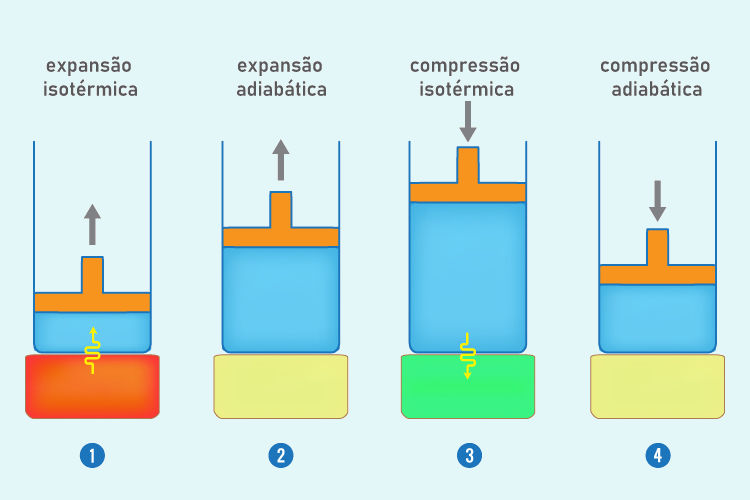
Esse ciclo ocorre por meio de quatro etapas de transformações termodinâmicas, independentemente da substância usada, conforme descrito pela imagem abaixo:
- Expansão isotérmica (temperatura constante) reversível: o sistema realiza trabalho e recebe calor da fonte quente.
- Expansão adiabática (sem trocas de calor) reversível: o sistema realiza trabalho e ocorre decréscimo da sua energia interna e temperatura.
- Compressão isotérmica (temperatura constante) reversível: o sistema recebe trabalho e fornece calor a fonte fria.
- Compressão adiabática (sem trocas de calor) reversível: o sistema tem sua temperatura elevada até igualar à da fonte quente para, só assim, entrarem em contato, completando o ciclo.
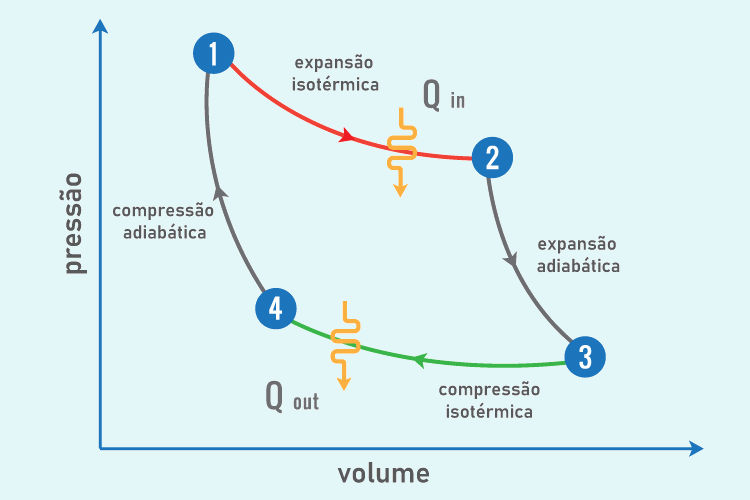
O gráfico do ciclo de Carnot é representado por um gráfico da pressão pelo volume, com o fluxo das quatro etapas de transformações termodinâmicas, conforme descrito na imagem abaixo:
Quais são as leis da termodinâmica?
Existem quatro leis que dão embasamento para o estudo da termodinâmica, sendo elas: a lei zero, a primeira lei, a segunda lei e a terceira lei da termodinâmica.
- Primeira lei da termodinâmica: refere-se à conservação da energia durante os processos termodinâmicos, tratando da relação entre a variação de energia interna, o trabalho e o calor. Saiba mais sobre essa lei clicando aqui.
- Segunda lei da termodinâmica: refere-se ao rendimento das máquinas térmicas e dos refrigeradores e sobre a entropia.
- Terceira lei da termodinâmica: refere-se aos resultados e à inviabilidade de se alcançar a temperatura de zero absoluto.
- Lei zero da termodinâmica: foi a última das leis da termodinâmica a ser desenvolvida. Contudo, tem essa nomenclatura pela necessidade de ser estudada antes da primeira lei da termodinâmica. É uma lei que se refere ao equilíbrio térmico atingido por corpos em distintas temperaturas. Para saber mais sobre essa lei, clique aqui.
Saiba mais: Termodinâmica — leis, fórmulas e principais conceitos
Exercícios sobre a segunda lei da termodinâmica
01) (UPE) Um refrigerador foi construído utilizando-se uma máquina de Carnot, cuja eficiência, na forma de máquina de calor, é igual a 0,1. Se esse refrigerador realiza um trabalho de 10J, é CORRETO afirmar que a quantidade de calor removida do reservatório de menor temperatura foi, em joules, de:
a) 100
b) 99
c) 90
d) 10
e) 1
Resolução:
Alternativa C
Primeiramente, calcularemos a quantidade de calor da fonte quente por meio da fórmula que a relaciona ao trabalho e ao rendimento da máquina térmica:
\(\eta = \frac{W}{Q_Q} \)
\(0{,}1 = \frac{10}{Q_Q} \)
\(Q_Q = \frac{10}{0{,}1} \)
\(Q_Q=100J\)
Posteriormente, calcularemos a quantidade de calor da fonte fria por meio da fórmula que a relaciona ao trabalho e à quantidade de calor da fonte quente:
\(W=Q_Q-Q_F\)
\(10=100-Q_F-90=-Q_F\)
\(Q_F=90J\)
02) Encontre o valor da variação da entropia em um sistema termodinâmico quando este sofre uma transformação termodinâmica isotérmica em 500K, variando a sua energia interna em 3∙107J.
a) 60.000J/K
b) 70.000J/K
c) 80.000J/K
d) 90.000J/K
e) 10.000J/K
Resolução:
Alternativa A
Calcularemos a entropia do sistema termodinâmico por meio fórmula que a relaciona à variação de energia interna e à temperatura:
\(\Delta S = \frac{\Delta U}{T} \)
\(\Delta S = \frac{3 \cdot 10^7}{500} \)
\(\Delta S = \frac{30{.}000{.}000}{500} \)
\(∆S=60.000 J⁄K\)
Nota
|1|HALLIDAY, D.; RESNICK, R.; WALKER, J. Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2). 10. ed. Rio de Janeiro, RJ: LTC, 2016.
Fontes
HALLIDAY, D.; RESNICK, R.; WALKER, J. Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2). 10. ed. Rio de Janeiro, RJ: LTC, 2016.
NUSSENZVEIG, H. M. Curso de física básica: fluidos, oscilações e ondas, calor (vol. 2). Editora Blucher, 2015.