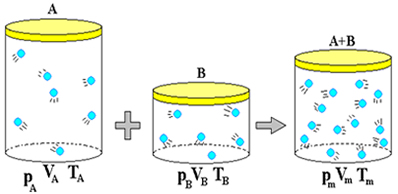
O gás ideal é aquele em que todas as suas partículas ou moléculas colidem-se de forma perfeitamente elástica, não havendo a presença de quaisquer forças intermoleculares. Nesse tipo de gás, a energia interna corresponde à soma das energias cinéticas de cada uma de suas partículas. Além disso, ele pode ser caracterizado por meio de três variáveis de estado: pressão, volume e temperatura.
Veja também: Exemplos de transformações gasosas
Tópicos deste artigo
- 1 - O que são gases?
- 2 - Características do gás ideal
- 3 - Leis dos gases
- 4 - Lei dos gases ideais
- 5 - Exercícios resolvidos sobre os gases ideais
O que são gases?
O gás é um dos estados físicos da matéria. Em temperaturas suficientemente altas, até mesmo elementos que são sólidos em temperatura ambiente tornam-se gases, portanto os gases são qualquer substância que se encontre no estado gasoso.
Os gases não apresentam forma definida e, por isso, tomam a forma de seus recipientes. Além disso, suas partículas movem-se com grande velocidade e encontram-se mais distantes umas das outras do que em outros estados físicos da matéria, como no caso dos líquidos e sólidos.

Características do gás ideal
As principais características dos gases ideais são a ausência de forças atrativas ou repulsivas entre suas partículas, que colidem elasticamente entre si, ou com as paredes do recipiente que os contém. Além disso, entende-se que, em um gás ideal, as moléculas ocupam um espaço desprezível.
Uma série de experimentos feitos ao longo da história mostra que quantidades fixas de um gás cujas características se assemelhem àquelas esperadas em um gás ideal obedecem a leis bastante simples. Se um gás ideal é aquecido dentro de um recipiente fechado e rígido (volume constante), a pressão do gás aumenta na mesma proporção que sua temperatura, em outras palavras, nessas condições, temperatura e pressão variam de forma diretamente proporcional.
Em resumo, podemos dizer que os gases ideias apresentam:
- ausência de forças de atração ou repulsão entre as moléculas do gás;
- colisões perfeitamente elásticas;
- partículas que não ocupam espaço e que se movem de forma desordenada.
É importante saber que, apesar de não existirem na prática, os gases ideais descrevem bem o comportamento de grande parte dos gases reais, se esses últimos estiverem sujeitos a baixas pressões e altas temperaturas.
Leis dos gases
As leis dos gases referem-se às transformações de estado sofridas por gases ideais. As principais transformações gasosas são descritas por essas leis, criadas por cientistas entre os séculos XVII e XIX.
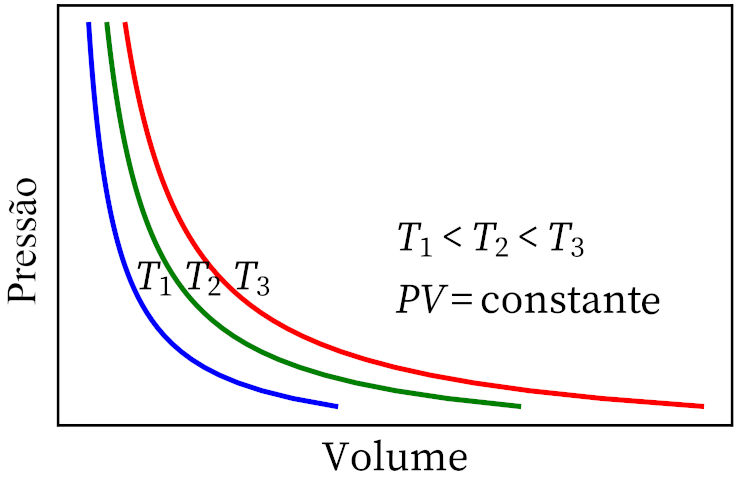
- Lei de Boyle: afirma que, em uma transformação isotérmica, a pressão e o volume de um gás são inversamente proporcionais entre si, de modo que o produto entre elas seja constante.
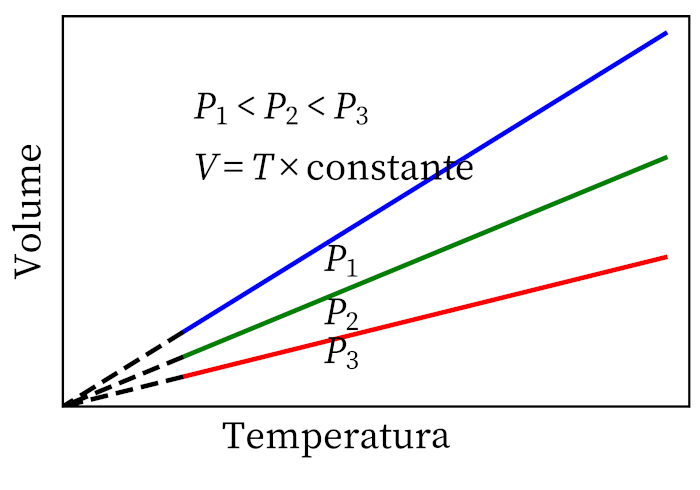
- Lei de Gay-Lussac: afirma que, sob pressão constante, o volume e a temperatura de um gás são proporcionais, por isso a razão entre eles é sempre constante.
- Lei de Charles: quando um gás sofre uma transformação a volume constante, sua pressão e temperatura são proporcionais, portanto a razão entre essas duas grandezas terá sempre a mesma medida.
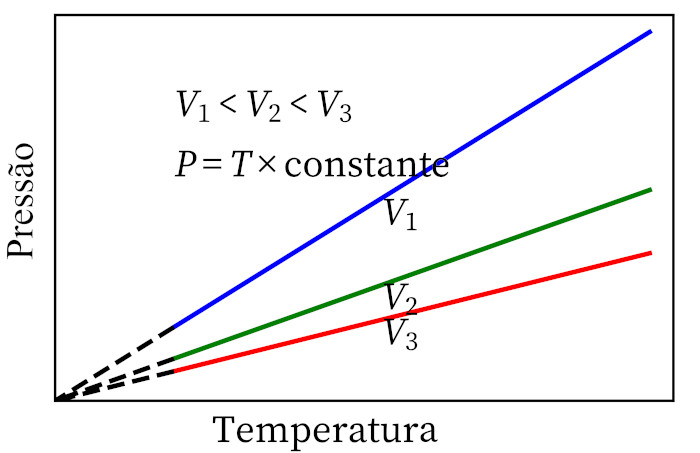
Lei dos gases ideais
A lei dos gases ideais afirma que o produto entre a pressão de um gás e o seu volume são proporcionais à temperatura do gás. A constante de proporcionalidade, nesse caso, é determinada pelo número de mols contidos no gás, bem como na constante universal dos gases ideais. A lei dos gases ideais está expressa a seguir:
![]()
P – pressão (atm, Pa)
V – volume (l, m³)
n – número de mols (mol)
R – constante universal dos gases ideais (0,082 atm.l/mol.K ou 8,3 J.mol/K)
T – temperatura termodinâmica (K)
Leia também: Cálculos com a equação geral dos gases
Exercícios resolvidos sobre os gases ideais
Questão 1 — Um gás ideal sofre uma transformação isotérmica na qual o seu volume é duplicado. Nesse caso, é correto dizer que:
a) a pressão final do gás será igual à metade da sua pressão inicial.
b) a temperatura final do gás será o dobro da temperatura inicial.
c) a pressão do gás permanecerá inalterada.
d) a pressão final do gás será igual ao dobro da pressão inicial.
Resolução:
Para resolver a questão, basta utilizarmos a lei geral dos gases, lembrando que, nesse caso, as temperaturas T1 e T2 são iguais.
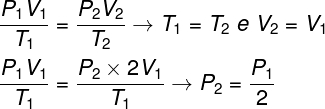
De acordo com o cálculo que fizemos, a pressão final do gás será igual à metade da medida da pressão inicial, portanto a alternativa correta é a letra A.
Questão 2 — Um mol de um gás ideal a 0 ºC (273 K) encontra-se sob uma pressão de 1 atm (1,0.105 Pa). Determine qual é o volume ocupado por esse gás, em litros, e assinale a alternativa correspondente. Use R = 0,082 atm.l/mol.K.
a) 44,8 l
b) 22,4 l
c) 36,4 l
d) 12,6 l
Resolução:
Para calcularmos o volume desse gás, é necessário aplicar a lei geral dos gases.
![]()
O cálculo mostra que 1 mol de gás ideal a 1 atm e 0 ºC ocupa um volume igual a 22,4 l. Dessa maneira, a alternativa correta é a letra B.