Sabemos que um líquido pode passar para o estado de vapor a uma temperatura menor que a temperatura de ebulição. A água, por exemplo, ferve a 100º C, embora ela possa se transformar em vapor tendo uma temperatura menor que a temperatura de ebulição.
Sabemos disso, pois, quando colocamos roupas molhadas no varal ou vasilhas lavadas no escorredor, verificamos que depois de algum tempo elas estão secas. Dessa forma, concluímos que a água vaporizou à temperatura ambiente, que por sinal é bem abaixo da temperatura de ebulição.
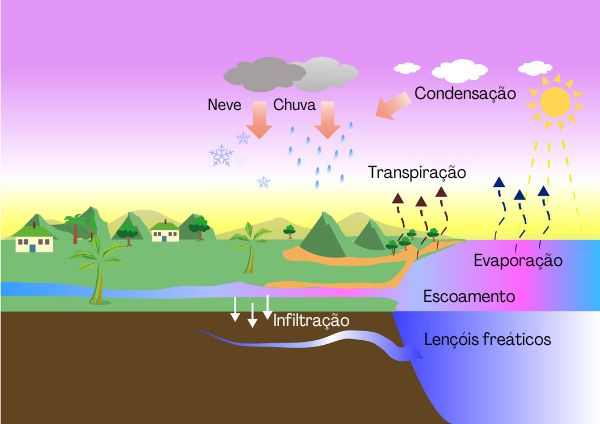
Podemos perceber esse fenômeno acontecendo nos rios, nos lagos e nos mares. Quando suas águas se vaporizam à temperatura ambiente, formam-se as nuvens. Mas como pode ocorrer essa vaporização?
As moléculas estão em constante movimento; dessa forma, podemos dizer que elas possuem energia cinética. No caso do líquido, várias moléculas possuem muita energia cinética e outras muitas moléculas possuem menor energia. As moléculas com mais energia cinética conseguem escapar, vencendo a tensão superficial do líquido e produzindo a vaporização superficial, que chamamos de evaporação. Veja a ilustração na figura abaixo:

Podemos definir então que a evaporação é uma vaporização do líquido a uma temperatura menor que a temperatura de ebulição.
A evaporação é um processo lento e depende da tensão superficial do líquido, por isso podemos dizer que líquidos que apresentam pequena tensão superficial evaporam com mais facilidade. Chamamos esses líquidos de voláteis.