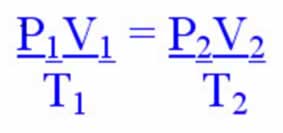A caracterização do estado de um gás pode ser feita por um conjunto de três variáveis: sua temperatura termodinâmica (T), sua pressão (p) e seu volume (V). Essas variáveis são denominadas variáveis de estado.
Por definição, um gás encontra-se em estado normal, ou em condições normais de temperatura e pressão (CNTP), ou ainda, em temperatura e pressão normais (TPN), quando sua pressão é a atmosférica normal e a temperatura é 0ºC.
Qualquer equação que apresente uma relação entre as variáveis de estado de um gás é denominada equação de estado do gás. A equação de estado do gás perfeito ou ideal é conhecida como equação de Clapeyron, em homenagem a Benoit Paul Émile Clapeyron que, em meio a muitos outros resultados importantes, escreveu tal equação como uma combinação de equações obtidas por outros físicos.
A equação de Clapeyron estabelece que a relação (p.V/T) é diretamente proporcional à quantidade de gás.
p.V=n.R.T
Em que n representa o número de mols do gás, obtido pela relação entre a massa m de gás (dada em gramas) e a molécula-grama M:

Onde R é a constante universal dos gases perfeitos.
O valor de R depende das unidades adotadas para a medida da pressão e do volume do gás:

Cabe lembrar que o mol é definido como sendo a quantidade de matéria que contém um número determinado de partículas, número esse denominado número de Avogadro. Essas partículas podem ser átomos, moléculas, íons, etc. Portanto, um mol pode ser definido da seguinte maneira:
1 mol=6,02 .1023 número de Avogadro (NA)
Dessa forma, podemos dizer que 1 mol de átomos corresponde exatamente a 6,02 . 1023 átomos. A molécula-grama do gás (M) é a massa, expressa em gramas, de 1 mol de moléculas do gás, ou seja, 6,02 . 1023 moléculas do gás. Então, por regra de três simples e direta: