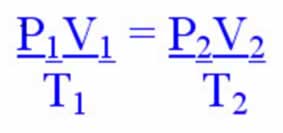Podemos falar que, ao longo da história, o trabalho realizado por vários cientistas investigadores foi de suma importância na formulação da lei dos gases ideais.
Nos experimentos realizados por Robert Boyle, pôde-se verificar que havia uma relação de proporção entre volume e pressão de um gás, quando a temperatura era mantida constante. Essa transformação recebeu o nome de transformação isotérmica.
Uma transformação é dita isotérmica quando a temperatura permanece constante. Nesse caso, a pressão varia de forma inversamente proporcional ao volume ocupado pelo gás.
A expressão que representa uma transformação isotérmica é conhecida como lei de Boyle-Mariotte e é representada pela seguinte equação:
p1V1 = p2V2
Onde: p1 é a pressão inicial, p2 é a pressão final, V1 volume inicial e V2 volume final.
Já o cientista Jaques Charles verificou a relação de proporção entre o volume e a temperatura de um gás quando a pressão era mantida constante.
Uma transformação é dita isobárica quando a pressão permanece constante. Nesse caso, o volume varia de forma diretamente proporcional à temperatura. A expressão para representar a transformação isobárica ficou conhecida como lei de Charles, e é representada pela equação:
V1 = V2
T1 T2
Onde: V1 volume inicial, V2 volume final, T1 temperatura inicial e T2 temperatura final.
O cientista Charles investigou também a relação existente entre a pressão e a temperatura quando o volume era mantido constante. Essa transformação é denominada isométrica, isocórica ou isovolumétrica.
Então, uma transformação é dita isovolumétrica quando o volume permanece constante, e a pressão varia proporcionalmente à temperatura. A equação que representa a lei de Charles para transformação isovolumétrica é:
p1 = p2
T1 T2
Onde: p1 é a pressão inicial, p2 é a pressão final, T1 temperatura inicial e T2 temperatura final.
Para uma transformação em que variam a pressão, o volume e a temperatura, ao mesmo tempo, temos a seguinte equação:
p1.V1 = p2.V2
T1 T2