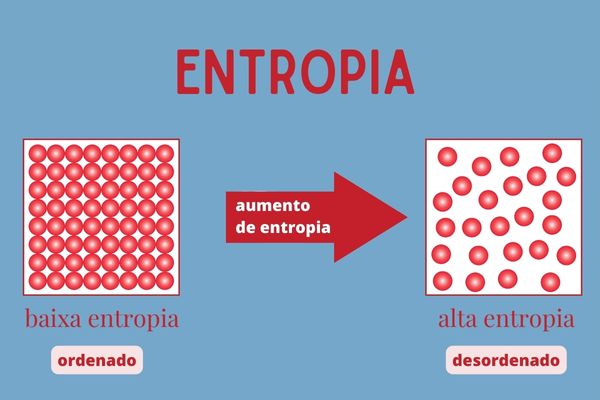
A entropia é uma grandeza física relacionada ao grau de desordem dos átomos e moléculas de um sistema, indicando o número de configurações possíveis que as partículas (átomos e moléculas) podem assumir.
Nos processos em que há perda de calor, temos a ordenação do sistema e, consequentemente, a diminuição da entropia. Já nos processos em que há ganho de calor, temos a desordenação do sistema, consequentemente temos o aumento da entropia.
Leia também: Como calcular a variação da entropia?
Tópicos deste artigo
- 1 - Resumo sobre entropia
- 2 - O que é entropia?
- 3 - Exemplos de entropia
- 4 - Tipos de entropia
- 5 - Características da entropia
- 6 - Fórmulas da entropia
- 7 - Relação entre entropia, termodinâmica e máquinas térmicas
- 8 - Entalpia e entropia
- 9 - Exercícios resolvidos sobre entropia
Resumo sobre entropia
- A entropia é uma grandeza física relacionada ao grau de desordem dos átomos e moléculas de um sistema, indicando as maneiras como estão ordenados nesse sistema.
- A entropia pode ser caracterizada como um processo espontâneo, natural, expansivo e que não obedece a uma lei de conservação.
- A variação de entropia pode ser positiva, negativa ou nula.
- A variação da entropia depende da variação da quantidade de calor e da temperatura.
- A variação da entropia em processos à temperatura constante pode ser calculada através da variação da quantidade de calor dividida pela temperatura.
- O rendimento das máquinas térmicas pode ser obtido através da fórmula da entropia.
- A entalpia trata das mudanças de calor em reações químicas sob pressão atmosférica constante.
O que é entropia?
A entropia é uma função de estado que depende exclusivamente do estado inicial e final de um gás, mas não da maneira pela qual o sistema passou de uma estado para outro. A nomenclatura entropia é originada do grego “εντροπία”, que significa “em mudança, em transformação”, e foi primeiramente introduzida pelo físico e matemático Rudolf Clausius (1822-1888).
Do ponto de vista da Física Estatística, a entropia é definida como a quantidade total de maneiras possíveis nas quais os átomos e moléculas de um sistema podem ser arranjados. Essa interpretação estatística foi formulada pelo físico Ludwing Boltzmann (1844-1906) e o cientista Josian Gibss (1839-1903) a partir dos trabalhos sobre a teoria cinética dos gases do físico e matemático James Maxwell (1831-1879), e contribiu no desenvolvimento de uma nova área da Física, a Mecânica Estátistica.
Exemplos de entropia
- Quando o gelo derrete, temos que as moléculas passam de uma forma mais ordenada para uma desordenada, assim temos aumento da entropia.
- Quando congelamos a água, temos que as moléculas passam de uma forma mais desordenada para uma ordenada, assim temos diminuição da entropia.
- Através de evidências observacionais, sabemos que o universo está em expansão, consequentemente a sua entropia está aumentando.
- Ao abrir um frasco de perfume, álcool ou acetona, temos a dissipação das suas moléculas, que partiram de um estado organizado a um estado desorganizado.
Tipos de entropia
A variação de entropia pode ser positiva, negativa ou nula.
- Variação de entropia positiva: indica que o sistema aumentou a sua desordem, ocorrendo de forma espontânea na natureza.
- Variação de entropia negativa: indica que o sistema diminuiu a sua desordem, não ocorrendo de forma espontânea na natureza, então é necessário transferir energia para o sistema a fim de que ocorra.
- Variação de entropia nula: indica, para qualquer processo adiabático (processo em que não há trocas de calor), que o sistema atingiu o zero absoluto, no qual todo o movimento atômico cessou — um estado de criogenia perfeito, o qual é um processo teórico, não ocorrendo na natureza.
Características da entropia
A entropia apresenta algumas características específicas.
- A entropia é um processo espontâneo, natural e expansivo.
- A entropia de um sistema termicamente isolado sempre aumenta, em processos irreversíveis.
- A entropia de um sistema termicamente isolado se mantém constante, em processos reversíveis.
- A entropia de um sistema termicamente isolado nunca diminuiu.
- A entropia não muda em um processo reversível e adiabático.
- A variação da entropia é proporcional à energia transferida na forma de calor para o sistema ou retirada do sistema durante o processo e é inversamente proporcional à temperatura.
- A entropia não obedece a uma lei de conservação, como a energia e as cargas elétricas.
Fórmulas da entropia
A entropia para processos isotérmicos (à temperatura constante) pode ser calculada através da fórmula:
\(∆S=\frac{∆Q}{T}\)
- ∆S → variação de entropia, medida em [J/K] .
- ∆Q → energia transferida na forma de calor para o sistema ou retirada do sistema durante o processo, medida em Joule [J] .
- T → temperatura, medida em Kelvin [K] .
Do ponto de vista estatístico, a entropia é calculada através da fórmula:
\(S=k\cdot ln\ W\)
- S → entropia de Boltzmann, medida em [J/K] .
- k → constante de Boltzmann, vale 1,4 ∙10-23 J/K .
- W → número de microestados possíveis para o sistema.
Relação entre entropia, termodinâmica e máquinas térmicas
A 2ª lei da termodinâmica, que trata das máquinas térmicas e do ciclo de Carnot, é naturalmente obtida a partir do estudo da entropia, de tal forma que através da fórmula da entropia é possível obter a fórmula que permite determinar a quantidade de energia que foi convertida em calor nos processos reversíveis, no equilíbrio térmico:
\(\frac{\left|Q_F\right|}{\left|Q_Q\right|}=\frac{T_F}{T_Q}\)
- \(\left|Q_F\right| \) → módulo do calor da fonte fria, medido em Joules [J] .
- \(\left|Q_Q\right| \) → módulo do calor da fonte quente, medido em Joules [J] .
- TF → temperatura da fonte fria, medida em Kelvin [K] .
- TQ → temperatura da fonte quente, medida em Kelvin [K] .
Com essa fórmula é possível calcular o rendimento das máquinas térmicas em termos das temperaturas da fonte fria e da fonte quente ou em termos do calor da fonte fria e da fonte quente.
Nenhuma máquina térmica possui um rendimento de 100%, já que sempre temos perda de calor durante o seu ciclo, com isso a variação de entropia do processo é positiva. Pensando nisso, o físico, matemático e engenheiro mecânico Sadi Carnot (1796-1832) formulou o ciclo de Carnot, ciclo termodinâmico ideal para obtenção do máximo rendimento de uma máquina térmica. Nesse ciclo a variação de entropia precisa ser nula.
Entalpia e entropia
A entalpia e a entropia são funções de estado distintas. Enquanto a entropia descreve o nível de desordem dos sistemas, a entalpia descreve as alterações de calor em reações químicas, em condições de pressão atmosférica constante. Quando a variação de entalpia for positiva o sistema ganhou calor da vizinhança (processo endotérmico), e a quando a variação de entalpia for negativa o sistema perdeu calor para a vizinhança (processo exotérmico).
Veja também: Como calcular a variação de entalpia?
Exercícios resolvidos sobre entropia
Questão 1
(Uece) Imagine um sistema termicamente isolado, composto por cilindros conectados por uma válvula, inicialmente fechada. Um dos cilindros contém um gás perfeito, mantido à pressão de 1 atm, e, no outro, tem-se vácuo. Abrindo-se a válvula:
A) o gás se expande e, assim, sua temperatura diminui.
B) a entropia do sistema se mantém constante, pois não há troca de calor.
C) a entropia do sistema aumenta, porque o processo é irreversível.
D) a energia interna do gás diminui, porque sua pressão diminui.
Resolução:
Alternativa C.
Quando abrimos a válvula o sistema se expande livremente, partindo de uma forma ordenada em direção a uma forma desordenada, assim temos um aumento da entropia do sistema.
Questão 2
(IME) Considere as supostas variações de entropia (ΔS) nos processos abaixo:
I. Cristalização do sal comum (ΔS > 0)
II. Sublimação da naftalina (naftaleno) (ΔS > 0)
III. Mistura de água e álcool (ΔS < 0)
IV. Ferro (s) → ferro (l) (ΔS > 0)
V. Ar → ar comprimido (ΔS < 0)
As variações de entropia indicadas nos processos que estão corretas são:
A) I, III e IV.
B) III, IV e V.
C) II, III e V.
D) I, II e IV.
E) II, IV e V.
Resolução:
Alternativa C.
I. Cristalização do sal comum (ΔS > 0) — Incorreto
A cristalização do sal comum é um processo de ordenamento dos íons, então há diminuição da entropia do sistema, ΔS < 0.
II. Sublimação da naftalina (naftaleno) (ΔS > 0) — Correto
III. Mistura de água e álcool (ΔS < 0) — Incorreto
A mistura de soluções de água e álcool aumenta a entropia do sistema, já que é um processo espontâneo, ΔS > 0.
IV. Ferro (s) → ferro (l) (ΔS > 0) — Correto
V. Ar → ar comprimido (ΔS < 0) — Correto
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2). 10. ed. Rio de Janeiro: LTC, 2016.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, Oscilações e Ondas, Calor (vol. 2). São Paulo: Editora Blucher, 2015.
SALINAS, Sílvio R. A. Introdução a física estatística (vol. 9). São Paulo: Editora da Universidade de São Paulo, 2005.