Este modelo, criado no início do século XX, é válido para a atualidade e sempre recebe aperfeiçoamento em razão das novas pesquisas realizadas por cientistas.
Podemos falar que o átomo é a menor partícula da matéria que mantém suas propriedades. Por exemplo, quando falamos do átomo de ferro, estamos falando da menor porção de ferro que ainda possui as mesmas propriedades dessa substância.
Embora nós saibamos que a palavra átomo significa indivisível, também temos consciência de que a ideia de indivisibilidade não se aplica, ou seja, está errada, pois o átomo é divisível e composto de partículas subatômicas.
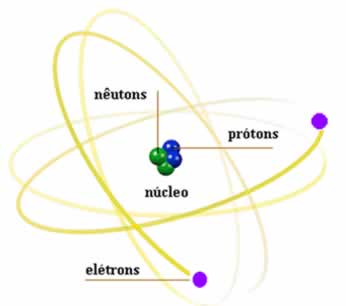
Das várias, ou melhor, inúmeras partículas que formam o átomo, três delas são mais estudas: prótons, nêutrons e elétrons.
Prótons
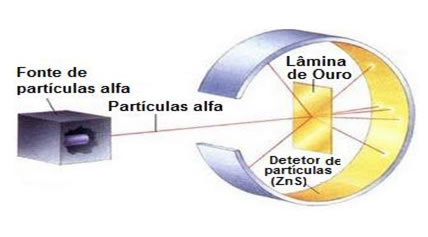
Mesmo sabendo que o núcleo atômico possuía pequenas dimensões e tinha carga elétrica, somente no ano de 1919, por meio de experimentos, é que se comprovou a existência do próton.
Hoje sabemos que eles estão no núcleo e que a massa de cada um deles é igual a 1,67 x 10-27 kg. Sua carga é convencionada como positiva (+1,6 x 10-19 C) e o número de prótons de um átomo determina o seu número atômico.
Nêutrons
No ano de 1920, Rutherford supôs a existência de uma partícula de carga elétrica neutra e com massa praticamente igual a do próton. Essa ideia era aceita na época, pois era a única forma de explicar o oxigênio 168O e seu isótopo 178O. A comparação da existência dessa partícula foi apresentada através de experimentos realizados pelo físico James Chadwick no ano de 1932.
Os nêutrons não possuem cargas, mas têm massa praticamente igual a do próton e estão no núcleo atômico.
Elétrons
Foi a primeira partícula a ser comprovada, ao se observar que os raios catódicos mudavam sua trajetória quando estavam na presença de um campo magnético.
Os elétrons estão ao redor do núcleo atômico, região denominada eletrosfera. Eles possuem cargas convencionadas negativas de (-1,6 x 10-19 C) e massa de 9,11 x 10-31 kg.
Aproveite para conferir nossas videoaulas relacionadas ao assunto: