As ligações químicas no Enem são cobradas por meio de questões que exigem do aluno saber quais são os tipos de ligação possíveis e suas características. É intrínseco a esse conteúdo saber também sobre a regra do octeto e suas exceções, considerando-se que ela explica a estabilidade do elemento, o número de ligações químicas necessárias, e por que as ligações químicas são necessárias.
Leia também: Temas de Química que mais caem no Enem
Tópicos deste artigo
- 1 - Como as ligações químicas são cobradas no Enem?
- 2 - O que são ligações químicas?
- 3 - Tipos de ligações químicas
- 4 - Questões sobre ligações químicas no Enem
Como as ligações químicas são cobradas no Enem?
As ligações químicas caem no Enem de forma contextualizada, e o aluno deve saber distinguir os três tipos principais de ligações — covalente, iônica e metálica — tendo apenas os dados sobre o ligante ou vice-versa; e saber qual a natureza dos átomos ligantes (metal, ametais...) de acordo com o tipo de ligação que está sendo realizada.
É recorrente que caiam questões sobre a regra do octeto e suas exceções. A regra do octeto define que, para que um átomo esteja estável, ele deve ter oito elétrons na sua camada de valência, no entanto, essa regra não se aplica a algumas espécies, sendo necessário, portanto, que o aluno saiba reconhecer e explicar esse fenômeno.
O que são ligações químicas?
As ligações químicas são as interações entre os átomos, o modo como se ligam e formam as moléculas que compõem a matéria. Os átomos, com exceção dos gases nobres, possuem naturalmente uma instabilidade eletrônica, e, de acordo com a regra do octeto, o elemento precisa ter em sua camada de valência oito elétrons para ser, assim, considerado estável. Hoje já se sabe que pode haver exceções a essa regra, mas ela ainda muito se aplica, principalmente para verificar-se quantas ligações são possíveis a um determinado átomo.
-
Regra do octeto
A regra do octeto dita que o elemento terá estabilidade quando tiver oito elétrons na camada de valência, ou seja, o oxigênio, por exemplo, que tem seis elétrons na camada de valência (1s² 2s² 2p4), precisa receber ou compartilhar outros dois elétrons. Como cada elétron simboliza uma ligação simples, o oxigênio, portanto, faz duas ligações.
-
Expansão do octeto: ocorre principalmente com fósforo (F) e enxofre (S), átomos grandes com subnível d desocupado, podendo comportar mais de oito elétrons na camada de valência.
-
Contração do octeto: é quando o átomo alcança estabilidade com menos de oito elétrons na camada de valência. Acontece, principalmente, com elementos do segundo período da Tabela Periódica, como berílio (Be) e boro (B).
Veja também: Propriedades da matéria no Enem: como esse tema é cobrado?
Tipos de ligações químicas
-
Ligação covalente: nesse tipo de ligação química, os átomos tendem a compartilhar os elétrons, não os doando ou recebendo, mas compartilhando um mesmo par eletrônico. Isso porque a diferença de eletronegatividade entre os ligantes não é muito grande. Esse tipo de ligação está presente em compostos orgânicos, hidrocarbonetos, e elementos simples, como Cl2, O2, H2. Quando houver diferença significativa entre os átomos de uma ligação covalente, a molécula formada será polar.
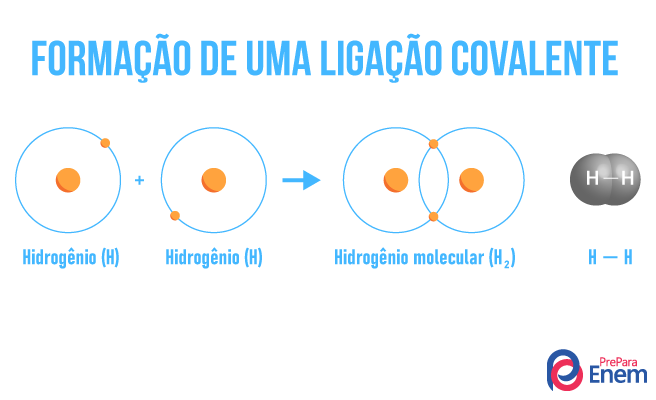
-
Ligação covalente dativa ou covalente coordenada: esse tipo de ligação é semelhante à ligação covalente, em que um elemento contribui com a estabilidade do outro compartilhando pares eletrônicos. A diferença é que, neste caso, o par eletrônico compartilhado será proveniente de apenas um dos átomos da ligação.
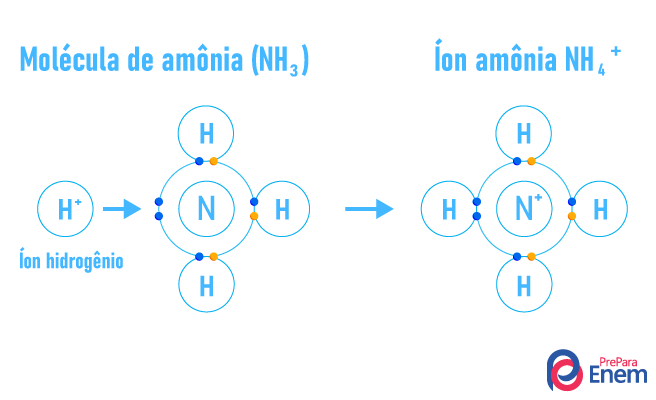
-
Ligação iônica: esse tipo acontece entre átomos com diferença de eletronegatividade, metais e ametais. Na ligação iônica, um dos átomos doa e o outro recebe elétrons, sendo que a espécie com maior eletronegatividade recebe os elétrons da outra espécie ligante.
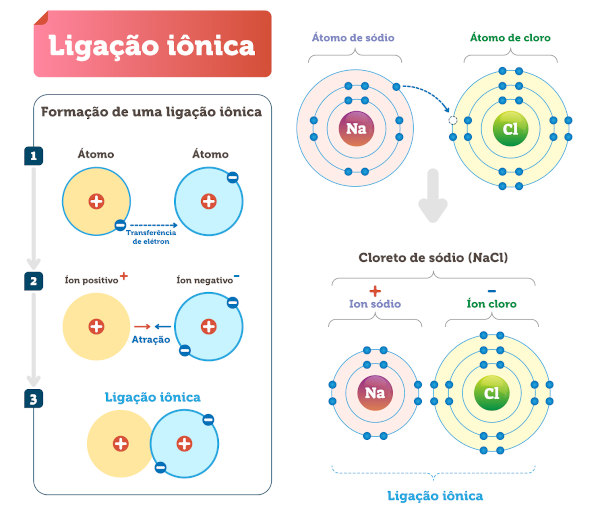
-
Ligação metálica: esse tipo de ligação química acontece entre metais da mesma espécie e metais de espécies diferentes (ligas metálicas). Nela haverá a movimentação dos elétrons entre um átomo e outro da molécula (mar de elétrons livres), os quais ficam presos à estrutura por atração eletrostática.
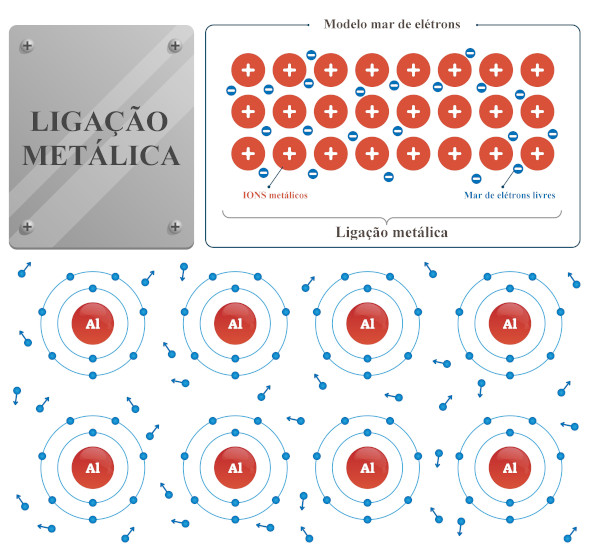
Acesse também: Dicas de Química para o Enem
Questões sobre ligações químicas no Enem
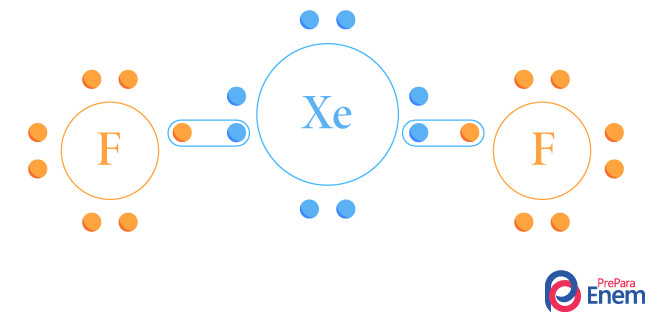
Questão 1 – (Enem 2019) Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
A) 6
B) 8
C) 10
D) 12
E) 14
Resolução
Alternativa C. Para responder a essa questão, não é necessário cálculo nem distribuição eletrônica, apenas atente-se às informações dadas pelo enunciado. Primeiro, o enunciado já afirmou que o xenônio é um gás nobre, portanto, possui oito e- em sua camada de valência (na qual acontece as ligações), e que a ligação que acontece no composto de interesse (difluoreto de xenônio) é uma covalente, ou seja, há compartilhamento de elétrons. Se o flúor tem sete e- na camada de valência, precisando, assim, de um e- cada átomo, e foram ligados dois átomos de flúor, então, no xenônio, teremos os oito elétrons já existentes mais dois elétrons que estão sendo compartilhados, totalizando 10 e-.
Questão 2 – (Enem 2014) O entendimento de como as ligações químicas se formam é um dos assuntos fundamentais da ciência. A partir desses fundamentos, pode-se entender como são desenvolvidos novos materiais. Por exemplo, de acordo com a regra do octeto, na formação de uma ligação covalente, os átomos tendem a completar seus octetos pelo compartilhamento de elétrons (atingir configuração de gás nobre, ns2 np6). Porém, quando o átomo central de uma molécula tem orbitais vazios, ele pode acomodar 10, 12 ou até mais elétrons.
Os elétrons desta camada de valência expandida podem estar como pares isolados ou podem ser usados pelo átomo central para formar ligações.
A estrutura que representa uma molécula com o octeto expandido (exceção à regra do octeto) é:
A) BF3.
B) NH3.
C) PCI5.
D) BeH2.
E) AlI3.
Resolução
Alternativa C. Analisando a distribuição eletrônica do fósforo (1s2 2s2 2p6 3s2 3p3), mais especificamente a camada de valência, podemos observar que, seguindo a regra do octeto, ele só deveria fazer três ligações, para ter, assim, um total de oito elétrons na sua última camada. No entanto, a expansão do octeto acontece devido ao tamanho do átomo e à presença do subnível d vazio, que pode comportar mais de 10 elétrons, o que é o caso do átomo de fósforo. Esse fenômeno acontece também ao enxofre (S).
Questão 3 – (Enem). A fosfatidilserina é um fosfolipídio aniônico cuja interação com cálcio livre regula processos de transdução celular e vem sendo estudada no desenvolvimento de biossensores nanométricos. A figura representa a estrutura da fosfatidilserina:
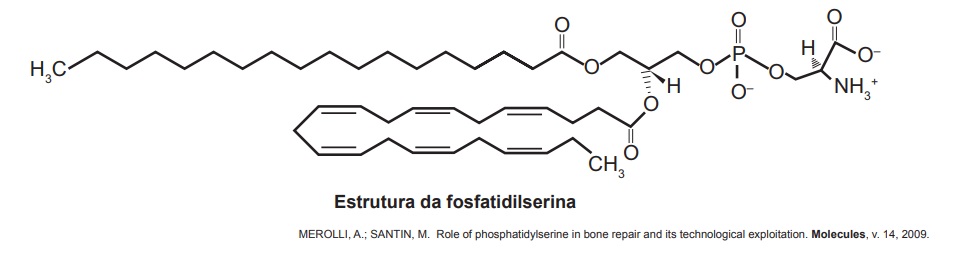
Com base nas informações do texto, a natureza da interação da fosfatidilserina com o cálcio livre é do tipo:
Dado: número atômico do elemento cálcio: 20
-
iônica somente com o grupo aniônico fosfato, já que o cálcio livre é um cátion monovalente.
-
iônica com o cátion amônio, porque o cálcio livre é representado como um ânion monovalente.
-
iônica com os grupos aniônicos fosfato e carboxila, porque o cálcio em sua forma livre é um cátion divalente.
-
covalente com qualquer dos grupos não carregados da fosfatidilserina, uma vez que eles podem doar elétrons ao cálcio livre para formar a ligação.
-
covalente com qualquer grupo catiônico da fosfatidilserina, visto que o cálcio na sua forma livre poderá compartilhar seus elétrons com tais grupos.
Resolução
Alternativa C. A questão trata de uma ligação intramolécular (covalente, metálica ou iônica), e tudo que temos para respondê-la é a informação sobre os ligantes: um deles será o íon cálcio, e os outros, observando a estrutura dada pelo enunciado, podemos ver que são um agrupamento fosfato e carboxila. Se os ligantes são um metal (cálcio) e um ametal, chegamos à conclusão de que se trata de uma ligação iônica, na qual os ligantes têm uma grande diferença de eletronegatividade.