Calcogênios são os elementos químicos do grupo 16 da Tabela Periódica. São eles: oxigênio (O), enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e livermório (Lv).
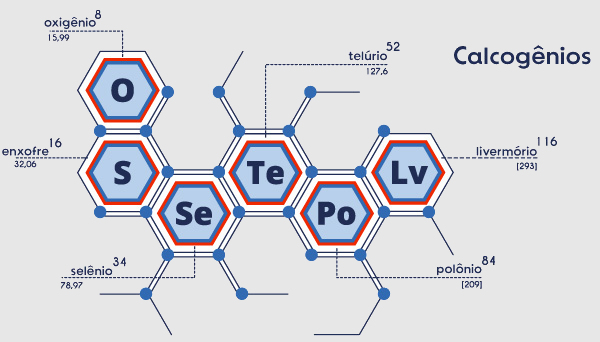
Calcogênios são os elementos que estão localizados no grupo 16 da Tabela Periódica. Tal grupo se inicia no segundo período e possui os seguintes elementos: oxigênio (O), enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e livermório (Lv). Esses elementos possuem como característica básica os seis elétrons na camada de valência.
Os calcogênios possuem um aumento do caráter metálico ao longo do grupo, sendo o polônio um elemento metálico, inclusive. Embora entenda-se que elementos do mesmo grupo tenham propriedades semelhantes, o oxigênio é o mais destacado, com alta eletronegatividade e alta energia de ionização, diferindo dos demais calcogênios. O polônio possui a particularidade de ser um elemento radioativo.
Leia também: Metais na Tabela Periódica — quais são eles, tipos e características
Resumo sobre calcogênios
-
Os calcogênios são os elementos pertencentes ao grupo 16 da Tabela Periódica.
-
São os elementos oxigênio (O), enxofre (S), selênio (Se), telúrio (Te) e polônio (Po).
-
O caráter metálico cresce ao longo do grupo, sendo o polônio um elemento considerado metálico.
-
O oxigênio é o elemento mais distinto quimicamente, por conta da alta eletronegatividade e alta energia de ionização, sendo S, Se e Te mais próximos quimicamente.
-
O polônio não possui isótopos estáveis, sendo um elemento radioativo.
-
O livermório foi descoberto recentemente, não havendo informações significativas ainda a seu respeito.
-
Os calcogênios possuem seis elétrons na camada de valência.
-
Não devem ser confundidos com os halogênios, os quais são os elementos pertencentes ao grupo 17 da Tabela Periódica.
O que são os calcogênios?
Os calcogênios são os elementos químicos localizados no grupo 16 da Tabela Periódica, iniciando-se no segundo período desta. O nome é entendido como “formador de minério” (tradução do inglês “ore builder”), derivando do grego antigo, sendo que o prefixo “chalcos” (ou khalkos”) significa “minério”.
Alguns autores também citam que, como essa mesma palavra fora utilizada para designar cobre e bronze, entendem que o nome “calcogênio” pode ser da associação de enxofre e outros elementos, como oxigênio, com o elemento cobre.
Quais são os calcogênios?
Na Tabela Periódica atual os calcogênios são:
-
oxigênio (O), número atômico 8;
-
enxofre (S), número atômico 16;
-
selênio (Se), número atômico 34;
-
telúrio (Te), número atômico 52;
-
polônio (Po), número atômico 84;
-
livermório (Lv), número atômico 116.
Veja também: 4 novos elementos químicos adicionados à Tabela Periódica
Principais características dos calcogênios
O oxigênio é um elemento central desse grupo, apresentando-se na natureza apenas na forma de dois alótropos: O2 (gás oxigênio ou dioxigênio) e O3 (gas ozônio ou ozona). Isso é diferente no enxofre, elemento que possui um alto número de alótropos (nenhum elemento possui mais formas alotrópicas que o enxofre), sendo a forma mais estável em condições ambiente o S8 ortorrômbico (α-S8).
O oxigênio também se destaca pela sua alta eletronegatividade (3,44), alta energia de ionização e pequeno raio atômico e, por conta disso, tal elemento não atua como átomo central em ligações ricas em elétrons, algo comum para outros calcogênios (como o enxofre).
Dentro do grupo dos calcogênios é possível perceber um aumento do caráter metálico junto com um aumento do período, assim o polônio acaba sendo o elemento de maior caráter metálico do grupo (o livermório é um elemento recém-descoberto, suas propriedades ainda são pouco conhecidas). Isso é mais explícito quando entendemos as condições de condutibilidade elétrica: o polônio é condutor, o telúrio e o selênio são semicondutores, enquanto todas as formas alotrópicas do enxofre são isolantes.
O conhecimento dos compostos de polônio, entretanto, é limitado. Isso porque não existem isótopos estáveis para esse elemento (são todos radioativos), além de não ser fácil manusear o isótopo mais comum do polônio, o 210Po. Tal isótopo é um importante emissor de partículas alfa, porém essa emissão libera uma quantidade substancial de energia (520 kJ.g−1.h−1), capaz de decompor a água e, assim, dificultando os estudos dos compostos de polônio em meio aquoso.
Uma condição interessante acerca de um calcogênio em específico é o caso do selênio. Este é considerado um elemento altamente tóxico, contudo pequenas concentrações de selênio são essenciais para nossa vida.
Propriedades dos calcogênios
Como dito anteriormente, o oxigênio se destaca por sua alta eletronegatividade. É o segundo elemento mais eletronegativo da Tabela Periódica, aliás, ficando apenas atrás do flúor (F, um halogênio). Essa condição, com o pequeno raio atômico, permite que compostos com ligação O−H façam interações intermoleculares do tipo ligação de hidrogênio, O−H∙∙∙X (sendo X = F, O ou N).
O enxofre, por exemplo, não consegue realizar tal interação intermolecular, pois não carrega as mesmas propriedades. A entalpia da ligação de hidrogênio S−H∙∙∙S é igual a, aproximadamente, 5 kJ/mol, muito menor que os 20 kJ/mol da ligação de hidrogênio O−H∙∙∙O presente na água.
O enxofre e o selênio possuem eletronegatividades muito próximas (de 2,4 a 2,6, a depender da escala de referência), além de energias de ionização próximas também. Com isso, como consequência percebe-se uma grande similaridade entre S e Se. Por conta disso, é comum que minerais contendo enxofre, geralmente, possuem também pequenas quantidades de selênio.
A tabela a seguir traz algumas propriedades interessantes dos calcogênios:
|
Propriedade |
O |
S |
Se |
Te |
Po |
|
Eletronegatividade |
3,44 |
2,58 |
2,55 |
2,1 |
2,0 |
|
1ª energia de ionização (kJ.mol−1) |
1314 |
1000 |
941 |
869 |
812 |
|
Afinidade eletrônica (kJ.mol−1) |
141 |
200 |
195 |
190 |
180 |
|
Ponto de fusão (°C) |
−218,8 |
112,8 |
217 |
452 |
250 |
|
Ponto de ebulição (°C) |
−183 |
444,7 |
685 |
990 |
962 |
A distribuição eletrônica dos calcogênios
Os calcogênios pertencem ao bloco p (uma parte dos elementos representativos) da Tabela Periódica, com configuração de camada de valência sempre igual a ns2 np4, sendo “n” o número do período do calcogênio.
|
Elemento |
Símbolo |
Número atômico |
Distribuição eletrônica |
|
Oxigênio |
O |
8 |
1s2 2s2 2p4 |
|
Enxofre |
S |
16 |
[Ne] 3s2 3p4 |
|
Selênio |
Se |
34 |
[Ar] 3d10 4s2 4p4 |
|
Telúrio |
Te |
52 |
[Kr] 4d10 5s2 5p4 |
|
Polônio |
Po |
84 |
[Xe] 4f14 5d10 6s2 6p4 |
|
Livermório |
Lv |
116 |
[Rn] 5f14 6d10 7s2 7p4 |
Aplicações dos calcogênios
→ Aplicações do oxigênio
O oxigênio, na forma de O2, é empregado como comburente (por exemplo, no oxiacetileno em soldas ou nas chamas de hidrogênio), como suporte para respiração em condições especiais e na confecção do aço.
→ Aplicações do enxofre
Para o enxofre, destaca-se um dos seus principais compostos, que é o ácido sulfúrico, H2SO4, essencial para a indústria química. O consumo de ácido sulfúrico por um país pode ser, inclusive, um indicador de desenvolvimento industrial. Entre os principais usos desse ácido está a produção de fertilizantes à base de fosfato.
→ Aplicações do selênio
O selênio amorfo tem a capacidade de converter luz em eletricidade, dessa forma o mesmo é utilizado em:
-
células fotovoltaicas;
-
fotocopiadoras;
-
medidores de exposição fotográfica;
-
detectores de imagens de raios X.
Além disso, o selênio é amplamente empregado na indústria de vidro, onde um composto vermelho brilhante, formado por uma combinação de CdS e CdSe, é utilizado em vidros coloridos.
→ Aplicações do telúrio
O telúrio é usado como aditivo em aços de baixo nível de carbono a fim de melhorar as propriedades mecânicas do material, sendo essa a principal forma de consumo do elemento. Além disso, é aplicado na matização de vidros, em catalisadores e como semicondutor.
→ Aplicações do polônio
O polônio, como já dito anteriormente, é radioativo (todos seus isótopos o são). Contudo, como suas emissões alfa são altamente exotérmicas (140 W/g), tem sido utilizado como fonte de calor para geração de energia termoelétrica em satélites espaciais. Para se ter noção, uma cápsula contendo 0,5 g de Po pode superar os 500 °C.
→ Aplicações do livermório
O livermório, recém-descoberto (2011), ainda não teve suas propriedades bem definidas. Seu isótopo mais estável, o 293Lv, tem uma meia-vida muito curta (na faixa dos 53 ms), o que impede estudos mais aprofundados. Além disso, a síntese do Lv é por meio da técnica “átomo-a-átomo”, ou seja, poucos átomos são sintetizados por semana, o que dificulta a sua produção em larga escala.
Diferenças entre calcogênios e halogênios
Os halogênios e calcogênios estão muito próximos na Tabela Periódica, ambos pertencendo ao bloco p da tabela. Contudo, os elementos considerados halogênios são aqueles que estão no grupo 17 (antigo VIIA) da Tabela Periódica, encabeçados pelo flúor (F).
Além disso, os halogênios possuem um elétron a mais que os calcogênios na camada de valência, sendo esta na configuração ns2 np5 (“n” significa o período). Os halogênios, em comparação aos calcogênios, são mais eletronegativos e possuem menor raio atômico. Outro ponto de diferença é que todos os halogênios são ametais, algo que não ocorre com os calcogênios (o Po já é considerado um elemento metálico).
Saiba mais: Quais são as características dos ametais?
Exercícios resolvidos sobre calcogênios
Questão 1. (Unirg/2022) Na natureza, o ferro não se apresenta na forma como costumamos ver no nosso cotidiano. Na verdade, ele é extraído de minérios onde se faz presente principalmente na forma de óxidos e sais.
A tabela a seguir exibe alguns minérios de ferro acompanhados das fórmulas de seus principais componentes.
|
Minério |
Principal componente |
|
Pirita |
FeS2 |
|
Siderita |
FeCO3 |
|
Hematita |
Fe2O3 |
|
Ilmenita |
FeTiO3 |
O minério considerado o mais importante dentre os listados tem, como principal componente, um composto binário que contém, na sua estrutura, o calcogênio mais eletronegativo.
Esse minério é denominado
-
pirita.
-
siderita.
-
hematita.
-
ilmenita.
Resposta: Letra C.
A questão fala, em primeiro momento, que devemos escolher o minério que é um composto binário, ou seja, aquele formado por apenas dois elementos químicos. Nesse sentido, sobram pirita e hematita.
Destes, pede-se para escolher o que possui, em sua estrutura, o calcogênio mais eletronegativo. Entre enxofre (S) e oxigênio (O), a maior eletronegatividade é do oxigênio. Assim sendo, a hematita atende aos critérios solicitados pela questão.
Questão 2. (Unicentro/2020) Os calcogênios são todos os elementos químicos localizados na família ou grupo 16, conhecida antigamente como família VIA, que recebem esse nome por causa da origem grega Khaltos, que significa cobre, com a junção do termo genos, que quer dizer “origem nobre”.
De uma forma geral, os calcogênios apresentam como principal característica o fato de os elementos naturais – com exceção do livermório, que é artificial – dessa família formarem compostos químicos com o elemento cobre (Cu). A denominação de calcogênios (geradores de cobre) é atribuída aos gregos, devido à obtenção de o cobre ser feita a partir de minérios, como Cu2O e Cu2S.
Em relação ao grupo dos calcogênios, pode-se afirmar:
-
É formado apenas por não metais.
-
Apresenta elementos químicos com subníveis d incompletos.
-
Contém os elementos químicos de mais baixa energia de ionização.
-
É isento de elementos químicos radioativos.
-
É constituído por elementos representativos.
Resposta: Letra E.
Letra A: incorreta, pois dentro dos calcogênios existem elementos metálicos também (caso do polônio).
Letra B: incorreta, pois o oxigênio não possui sequer subníveis d, e, além disso, os demais calcogênios possuem subnível d completo.
Letra C: incorreta, pois os calcogênios não possuem menor energia de ionização, sendo isso caraterística de metais alcalinos e alcalino-terrosos.
Letra D: incorreta, pois o polônio é radioativo.
Letra E: correta, pois os calcogênios estão no bloco p, que, junto com o bloco s, forma os elementos representativos da Tabela Periódica.
Fontes
FISCHER, W. A second note on the term “chalcogen”. Journal of Chemical Education. v. 78, n. 10. p. 1333. out. 2001.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 4. ed. Harlow (Inglaterra): Pearson Education Limited, 2012.
JENSEN, W. B. A note on the term “chalcogen”. Journal of Chemical Education. v. 74, n. 9, p. 1063, set. 1997.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. São Paulo: Pearson Education do Brasil, 2014.
